Atom, choć niewidoczny gołym okiem i niewyobrażalnie mały, jest fundamentalnym budulcem wszystkiego, co nas otacza od najmniejszych cząsteczek powietrza po gigantyczne gwiazdy. Zrozumienie jego budowy to klucz do poznania podstawowych zasad rządzących materią i energią we wszechświecie.
Atom podstawowy składnik materii zbudowany z jądra i chmury elektronowej
- Atom składa się z dodatnio naładowanego jądra atomowego oraz otaczającej je ujemnie naładowanej chmury elektronowej.
- Jądro atomowe, mimo niewielkiej objętości, zawiera ponad 99,9% masy atomu i składa się z protonów (ładunek dodatni) oraz neutronów (ładunek obojętny).
- Liczba protonów w jądrze (liczba atomowa Z) jednoznacznie określa tożsamość pierwiastka chemicznego.
- Chmura elektronowa to obszar, w którym krążą elektrony (ładunek ujemny), a ich położenie jest opisywane probabilistycznie.
- Elektrony na najbardziej zewnętrznej powłoce (walencyjne) są kluczowe dla tworzenia wiązań chemicznych.
- Protony i neutrony nie są cząstkami elementarnymi; są zbudowane z jeszcze mniejszych cząstek zwanych kwarkami.
Kiedy zagłębiamy się w świat materii, szybko dochodzimy do wniosku, że wszystko, co nas otacza, składa się z niewyobrażalnie małych, ale niezwykle złożonych struktur atomów. To właśnie one stanowią podstawowy składnik materii, zachowujący właściwości chemiczne danego pierwiastka. Ich skala jest tak mikroskopijna, że nawet miliardy atomów ułożonych obok siebie byłyby wciąż niewidoczne dla ludzkiego oka, a jednak to w nich tkwi cała tajemnica chemii i fizyki.
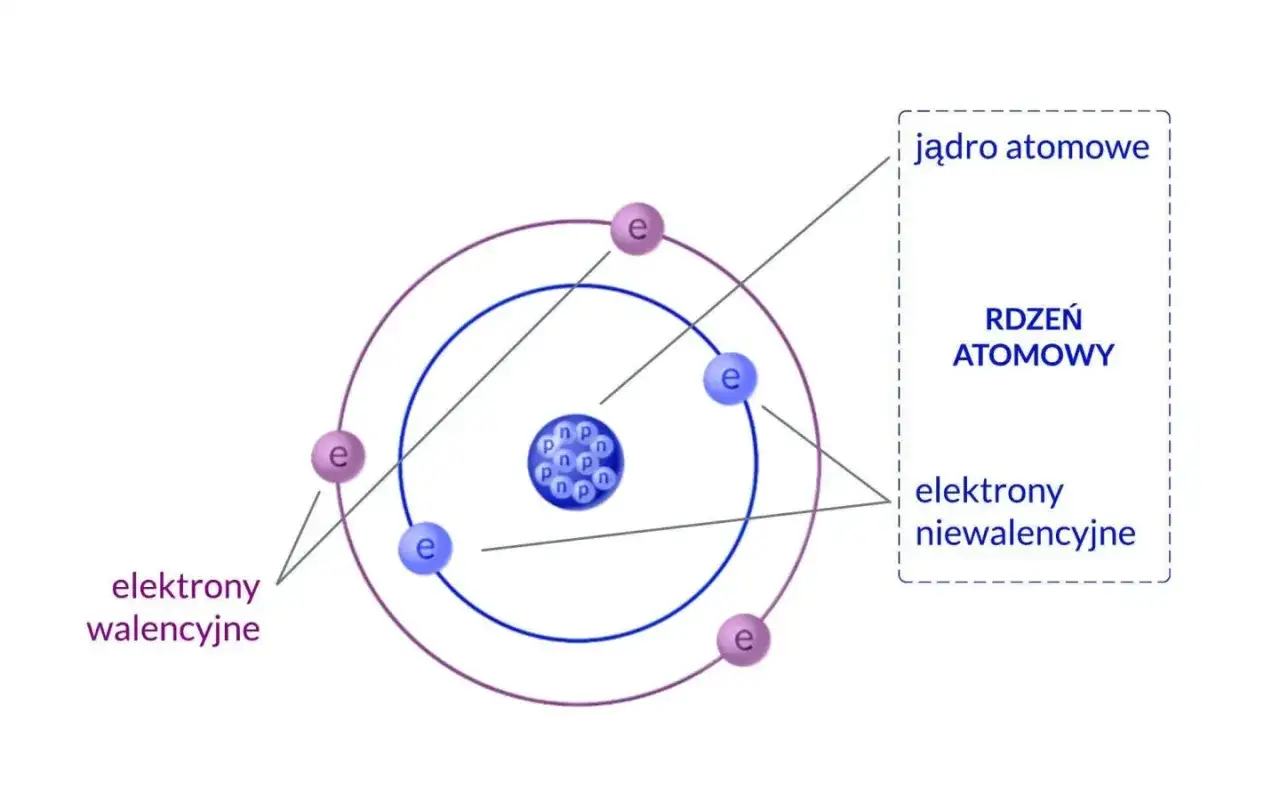
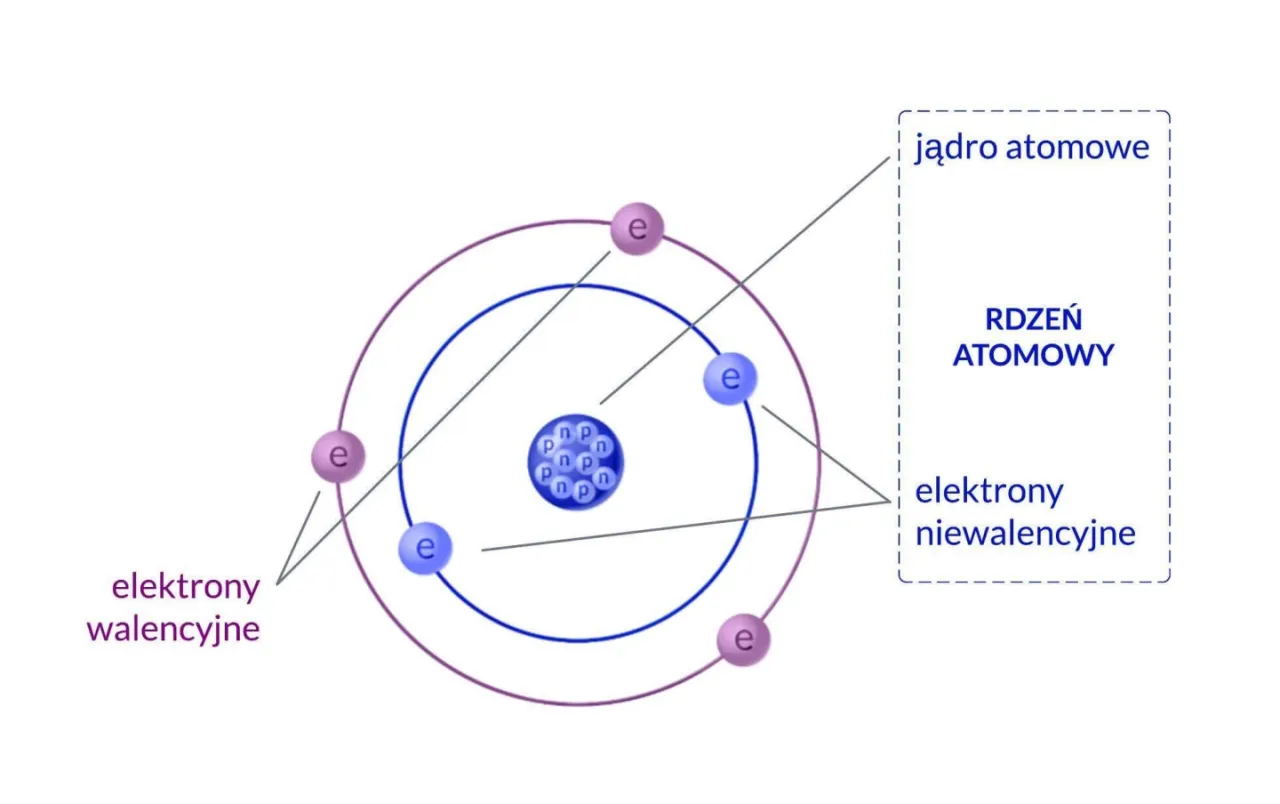
Każdy atom, niezależnie od tego, czy jest to atom wodoru, węgla czy złota, składa się z dwóch głównych, wyraźnie odrębnych części. W samym centrum znajduje się dodatnio naładowane jądro atomowe, a wokół niego rozciąga się ujemnie naładowana chmura elektronowa. Te dwie części, choć różnią się wielkością i ładunkiem, są ze sobą ściśle powiązane, tworząc stabilną i spójną całość.
Jądro atomowe jest prawdziwym sercem atomu. Znajduje się w jego centrum i, co ciekawe, mimo że zajmuje zaledwie ułamek objętości całego atomu, to właśnie ono koncentruje w sobie ponad 99,9% jego masy. Jądro jest naładowane dodatnio, a jego składnikami są cząstki zbiorczo nazywane nukleonami: protony i neutrony. To od ich liczby i wzajemnych oddziaływań zależy stabilność i tożsamość atomu.
Wokół tego gęstego, dodatnio naładowanego jądra rozciąga się chmura elektronowa. Jest to obszar, w którym znajdują się elektrony cząstki o ładunku ujemnym. Chmura elektronowa, w przeciwieństwie do jądra, zajmuje znacznie większą objętość, nadając atomowi jego rozmiar. Co ważne, położenie elektronów w tej chmurze nie jest ściśle określone; zamiast precyzyjnych orbit, mówimy o obszarach największego prawdopodobieństwa ich znalezienia, co jest jednym z fundamentalnych założeń mechaniki kwantowej.
Aby w pełni zrozumieć, jak działa atom, musimy przyjrzeć się jego "mieszkańcom" cząstkom subatomowym. To właśnie protony, neutrony i elektrony, ze swoimi unikalnymi właściwościami, decydują o tym, jak atom oddziałuje z innymi atomami i jak zachowuje się materia na poziomie makroskopowym. Przejdźmy zatem do szczegółowego omówienia każdej z tych fascynujących cząstek.
Zacznijmy od nukleonów. To zbiorcza nazwa dla dwóch typów cząstek, które wspólnie tworzą jądro atomowe: protonów i neutronów. Są one ze sobą silnie związane, a ich obecność w jądrze jest kluczowa dla jego stabilności i charakterystyki danego pierwiastka.
Protony, oznaczane jako p+, to cząstki posiadające dodatni ładunek elektryczny. Są one umiejscowione w jądrze atomowym i to właśnie ich liczba, zwana liczbą atomową (Z), jest fundamentalną cechą, która jednoznacznie określa tożsamość pierwiastka chemicznego. Na przykład, każdy atom wodoru ma dokładnie jeden proton w swoim jądrze, węgiel zawsze sześć, a złoto siedemdziesiąt dziewięć. Zmieniając liczbę protonów, zmieniamy pierwiastek!
Neutrony, oznaczane jako n⁰, to cząstki elektrycznie obojętne, również znajdujące się w jądrze atomowym. Ich rola jest niezwykle ważna działają jak "klej", który stabilizuje jądro, przeciwdziałając silnym siłom odpychania elektrostatycznego między dodatnio naładowanymi protonami. Co ciekawe, atomy tego samego pierwiastka mogą mieć różną liczbę neutronów. Takie odmiany nazywamy izotopami. Klasycznym przykładem są izotopy wodoru: prot (bez neutronów), deuter (jeden neutron) i tryt (dwa neutrony), które mimo różnej masy, zachowują te same właściwości chemiczne.
Elektrony, oznaczane jako e⁻, to cząstki o ujemnym ładunku elektrycznym. Są one znacznie lżejsze od protonów i neutronów ich masa jest około 1836 razy mniejsza. Elektrony nie znajdują się w jądrze, lecz krążą wokół niego w chmurze elektronowej, zajmując określone obszary nazywane powłokami i podpowłokami elektronowymi. Ich ruch jest niezwykle szybki i nie da się go opisać jako precyzyjnych orbit, jak w modelu planetarnym. Zgodnie z zasadą nieoznaczoności Heisenberga, możemy mówić jedynie o prawdopodobieństwie znalezienia elektronu w danym miejscu w przestrzeni wokół jądra.
Powłoki elektronowe to nic innego jak kolejne "warstwy" wokół jądra, na których elektrony mogą się znajdować. Każda powłoka ma określoną pojemność i energię. Ich istnienie jest niezwykle ważne, ponieważ to właśnie rozmieszczenie elektronów na tych powłokach, a zwłaszcza na tej najbardziej zewnętrznej, decyduje o właściwościach chemicznych atomu i jego zdolności do tworzenia wiązań.
Szczególnie istotne są elektrony walencyjne. To elektrony znajdujące się na najbardziej zewnętrznej, czyli ostatniej, powłoce elektronowej atomu. Są one kluczowe, ponieważ to właśnie one biorą udział w tworzeniu wiązań chemicznych z innymi atomami. Ich liczba i konfiguracja decydują o tym, jak atom będzie reagował, czy będzie tworzył wiązania kowalencyjne, jonowe, czy metaliczne, a w konsekwencji jakie właściwości będzie miała tworzona przez niego materia.
Skoro wiemy już, z czego zbudowany jest atom, naturalnie nasuwa się pytanie: co utrzymuje te wszystkie cząstki razem? Jak to się dzieje, że dodatnio naładowane protony w jądrze nie odpychają się nawzajem, a elektrony nie uciekają od dodatnio naładowanego jądra? Odpowiedzią są fundamentalne oddziaływania natury, które działają na poziomie subatomowym.
Pierwszą z nich jest oddziaływanie silne, często nazywane siłami jądrowymi. Jest to najsilniejsze z czterech poznanych oddziaływań podstawowych we wszechświecie. Jego rola jest absolutnie kluczowa: to właśnie ono wiąże protony i neutrony w jądrze atomowym, pokonując potężne siły odpychania elektrostatycznego, które naturalnie występowałyby między dodatnio naładowanymi protonami. Bez oddziaływania silnego, jądra atomowe po prostu by się rozpadły.
Drugą ważną siłą jest siła elektromagnetyczna. To ona odpowiada za przyciąganie ujemnie naładowanych elektronów przez dodatnio naładowane jądro. Dzięki niej elektrony są utrzymywane w chmurze elektronowej, krążąc wokół jądra. To właśnie równowaga między siłą elektromagnetyczną a energią kinetyczną elektronów sprawia, że atom jest stabilną strukturą, a elektrony nie spadają na jądro ani nie uciekają w przestrzeń.
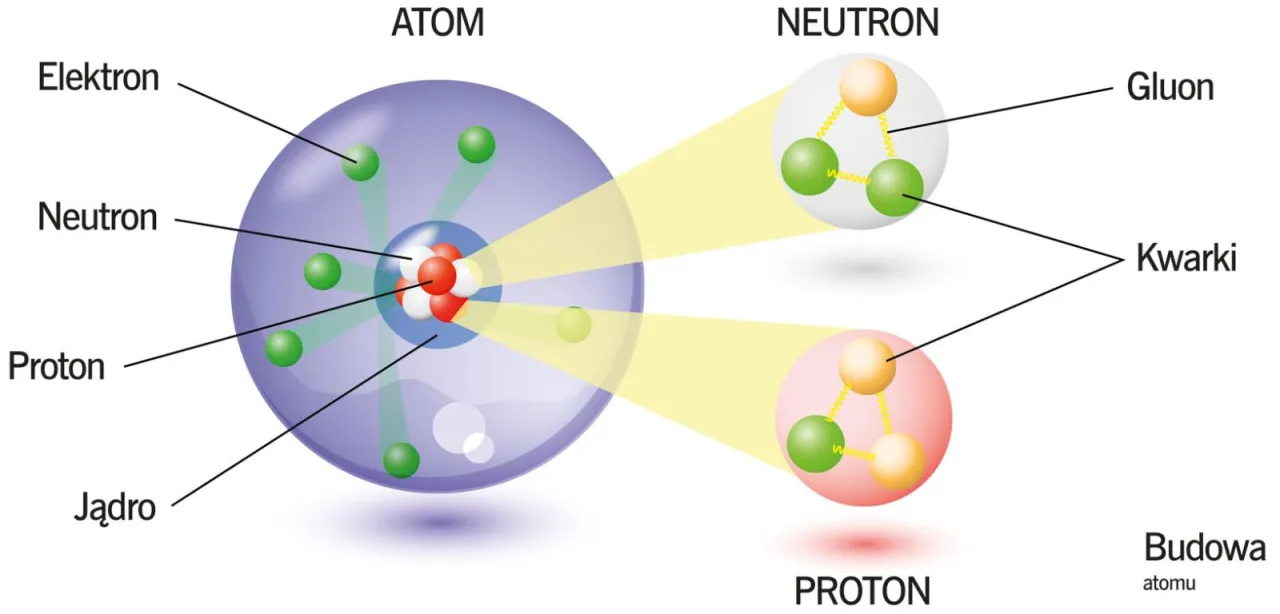
Wspomniałem wcześniej, że jądro atomowe składa się z protonów i neutronów. Przez długi czas uważano je za cząstki elementarne, czyli takie, które nie posiadają wewnętrznej struktury. Jednak współczesna fizyka cząstek elementarnych pokazała, że zarówno protony, jak i neutrony, nie są fundamentalne, lecz mają swoje własne, jeszcze mniejsze składniki.
Tymi ostatecznymi fundamentami, z których zbudowane są nukleony, są kwarki. To fascynujące cząstki, które występują w sześciu "smakach" (górny, dolny, dziwny, powabny, piękny, prawdziwy). Proton składa się z dwóch kwarków górnych (up) i jednego kwarka dolnego (down), natomiast neutron zbudowany jest z jednego kwarka górnego (up) i dwóch kwarków dolnych (down). Kwarki są ze sobą związane przez oddziaływanie silne, przenoszone przez cząstki zwane gluonami.
Cała ta wiedza o najmniejszych składnikach materii jest ujęta w Modelu Standardowym fizyki cząstek. Jest to współczesna teoria, która opisuje wszystkie znane cząstki elementarne oraz trzy z czterech podstawowych oddziaływań natury (silne, słabe i elektromagnetyczne). Model Standardowy to jedno z największych osiągnięć fizyki XX wieku, które pozwala nam zrozumieć, z czego naprawdę zbudowany jest wszechświat na najbardziej fundamentalnym poziomie.
Nasze obecne rozumienie budowy atomu nie pojawiło się z dnia na dzień. Jest to efekt stuleci badań, eksperymentów i ewolucji myśli naukowej. Od najwcześniejszych, filozoficznych koncepcji starożytnych Greków po złożone teorie kwantowe, modele atomu zmieniały się, stając się coraz bardziej precyzyjne i zgodne z obserwacjami. Warto przyjrzeć się kilku kluczowym etapom tej fascynującej podróży.
Jednym z przełomowych był model planetarny Bohra, zaproponowany w 1913 roku. Niels Bohr zrewolucjonizował ówczesne myślenie, postulując, że elektrony krążą wokół jądra po ściśle określonych, stabilnych orbitach, podobnie jak planety wokół Słońca. Każdej orbicie odpowiadał określony poziom energii. Model Bohra doskonale wyjaśniał widma emisyjne wodoru, co było jego ogromnym sukcesem. Mimo to, miał swoje ograniczenia nie potrafił opisać bardziej złożonych atomów ani wyjaśnić intensywności linii widmowych.
Ograniczenia modelu Bohra doprowadziły do rozwoju współczesnego modelu kwantowo-mechanicznego, często nazywanego modelem chmurowym. W tym ujęciu atom nie jest już postrzegany jako miniaturowy układ planetarny. Elektrony nie krążą po ściśle określonych torach, lecz ich położenie jest opisywane przez funkcje prawdopodobieństwa, tworząc swego rodzaju "chmurę" wokół jądra. Ten model, oparty na równaniu Schrödingera i zasadach mechaniki kwantowej, jest znacznie bardziej złożony, ale jednocześnie znacznie dokładniejszy i pozwala wyjaśnić szeroki zakres zjawisk atomowych i molekularnych.
Dogłębne zrozumienie budowy atomu, od jego podstawowych składników po subtelne oddziaływania kwantowe, jest absolutnie kluczowe dla rozwoju niezliczonych dziedzin nauki i technologii. To właśnie ta wiedza stanowi fundament dla chemii, pozwalając nam przewidywać i kontrolować reakcje chemiczne, a także dla fizyki jądrowej, która bada procesy zachodzące w jądrach atomowych. Ma ona również ogromne znaczenie w materiałoznawstwie, umożliwiając projektowanie nowych materiałów o pożądanych właściwościach, a także w medycynie, gdzie techniki takie jak rezonans magnetyczny czy radioterapia opierają się na manipulacji atomami i ich składnikami. Bez tej fundamentalnej wiedzy nasz świat wyglądałby zupełnie inaczej.