W świecie chemii organicznej mydła to znacznie więcej niż tylko codzienne środki higieny. To fascynujące związki chemiczne, których działanie opiera się na precyzyjnych mechanizmach molekularnych. W tym artykule, jako Daniel Kowalski, zabieram Państwa w podróż do wnętrza cząsteczki mydła, aby wyjaśnić jego chemiczną definicję, proces powstawania oraz niezwykłe właściwości, które sprawiają, że brud znika z powierzchni.
Mydła to sole kwasów tłuszczowych poznaj ich chemiczną definicję i mechanizm działania.
- Mydła to sole metali alkalicznych (sodu, potasu) i wyższych kwasów tłuszczowych (np. palmitynowego, stearynowego, oleinowego).
- Powstają w reakcji zmydlania tłuszczów, czyli hydrolizy estrów w środowisku zasadowym.
- Ich skuteczność myjąca wynika z amfifilowej budowy cząsteczki, która pozwala na tworzenie miceli i emulgowanie brudu.
- Wyróżnia się mydła sodowe (twarde), potasowe (miękkie) oraz nierozpuszczalne (litowe, wapniowe, magnezowe, glinowe) o specjalnych zastosowaniach.
- Wodne roztwory mydeł mają odczyn zasadowy, co jest efektem hydrolizy anionowej.
Mydło z perspektywy chemika: więcej niż zwykła kostka
Z chemicznego punktu widzenia, mydła to nic innego jak sole wyższych kwasów tłuszczowych. Najczęściej są to sole metali alkalicznych, takich jak sód i potas, choć istnieją również mydła innych metali. Kwasy tłuszczowe, z których powstają mydła, to długołańcuchowe kwasy karboksylowe, na przykład kwas palmitynowy (C15H31COOH), stearynowy (C17H35COOH) czy oleinowy (C17H33COOH). Ich długie łańcuchy węglowodorowe odgrywają kluczową rolę w mechanizmie działania mydła.
Dlaczego mydło to sól? Rozkładamy budowę cząsteczki na czynniki pierwsze
Kluczem do zrozumienia działania mydła jest jego unikalna budowa, którą chemicy nazywają amfifilową. Oznacza to, że każda cząsteczka mydła składa się z dwóch wyraźnie różnych części. Pierwsza to hydrofilowa "głowa", czyli grupa karboksylanowa (-COO⁻), która ma silne powinowactwo do wody. Druga to hydrofobowy "ogon", czyli długi łańcuch węglowodorowy, który "nie lubi" wody, ale za to doskonale rozpuszcza się w tłuszczach i olejach.
Dwa oblicza jednej cząsteczki: rola części hydrofilowej i hydrofobowej
Ta dwoista natura cząsteczki mydła jest fundamentem jej właściwości myjących. Hydrofilowa głowa, będąc naładowaną ujemnie, chętnie wchodzi w interakcje z cząsteczkami wody, które również są polarne. Z kolei hydrofobowy ogon, ze względu na swoją niepolarną budowę, dąży do unikania wody i zamiast tego woli zanurzać się w substancjach tłuszczowych. To właśnie ta specyficzna budowa pozwala mydłu na jednoczesne oddziaływanie zarówno z wodą, jak i z brudem o charakterze tłuszczowym, co jest niezbędne do skutecznego usuwania zanieczyszczeń.
Jak powstaje mydło? Krok po kroku przez proces zmydlania
Zrozumienie chemicznej definicji mydła prowadzi nas naturalnie do pytania o jego pochodzenie. Proces, w którym mydło jest wytwarzane, to fascynująca reakcja chemiczna, znana jako zmydlanie.
Na czym polega reakcja zmydlania tłuszczów?
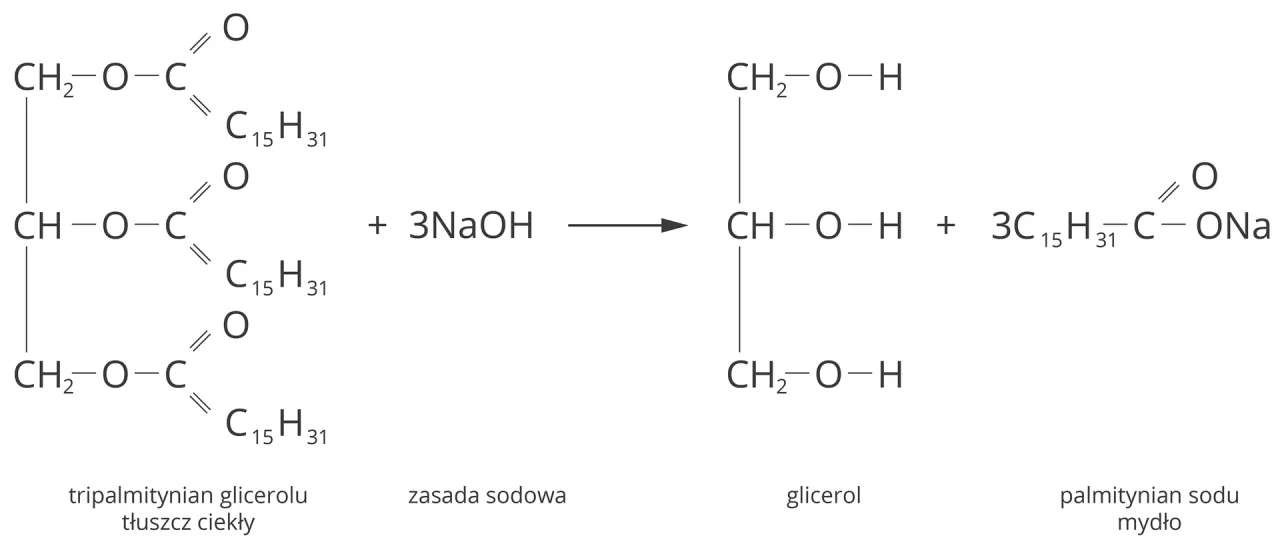
Reakcja zmydlania tłuszczów to klasyczny przykład hydrolizy estrów w środowisku zasadowym. W praktyce polega ona na długotrwałym gotowaniu tłuszczów zarówno zwierzęcych, jak i roślinnych z mocną zasadą. Najczęściej stosuje się wodorotlenek sodu (NaOH) do produkcji mydeł twardych lub wodorotlenek potasu (KOH) do mydeł miękkich. W wyniku tego procesu, wiązania estrowe w cząsteczkach tłuszczu ulegają rozerwaniu, prowadząc do powstania mydła i glicerolu.
Substraty i produkty: co jest potrzebne, a co powstaje w tej reakcji?
Do przeprowadzenia reakcji zmydlania potrzebujemy dwóch kluczowych substratów: tłuszczu (czyli trójglicerydu) oraz mocnej zasady. W wyniku tej reakcji otrzymujemy dwa główne produkty: mydło, które jest solą kwasu tłuszczowego, oraz glicerol (glicerynę). Warto dodać, że mydła można również otrzymać w bezpośredniej reakcji odpowiedniego kwasu tłuszczowego z zasadą, co jest często stosowane w przemyśle.
Równanie reakcji zmydlania: przykład dla stearynianu sodu
Ogólne równanie reakcji zmydlania trójglicerydu wygląda następująco:
Tłuszcz (trójgliceryd) + 3 NaOH/KOH → Mydło (sól kwasu tłuszczowego) + Glicerol
Dla przykładu, zmydlanie tristearynianu glicerolu (typowego tłuszczu) wodorotlenkiem sodu prowadzi do powstania stearynianu sodu (mydła) i glicerolu:
C3H5(C17H35COO)3 + 3 NaOH → 3 C17H35COONa + C3H5(OH)3
W tym równaniu C3H5(C17H35COO)3 to tristearynian glicerolu, C17H35COONa to stearynian sodu (mydło), a C3H5(OH)3 to glicerol.
Gliceryna: cenny produkt uboczny, o którym warto wiedzieć
Glicerol, często nazywany gliceryną, jest nie tylko produktem ubocznym reakcji zmydlania, ale także bardzo cenną substancją. To bezbarwny, lepki płyn o słodkim smaku, który ma właściwości higroskopijne, czyli zdolność do wiązania wody. Dzięki temu znajduje szerokie zastosowanie w przemyśle kosmetycznym (jako składnik kremów i balsamów), farmaceutycznym, a także spożywczym.
Tajemnica działania mydła: jak brud znika z powierzchni
Poznaliśmy już, czym jest mydło i jak powstaje. Teraz przyszedł czas na najbardziej intrygujący aspekt zrozumienie, w jaki sposób ta prosta substancja radzi sobie z brudem. To prawdziwa magia chemii, którą zaraz Państwu wyjaśnię.
Krok 1: Zmniejszenie napięcia powierzchniowego wody
Pierwszym i fundamentalnym krokiem w działaniu mydła jest obniżenie napięcia powierzchniowego wody. Czysta woda ma stosunkowo wysokie napięcie powierzchniowe, co sprawia, że tworzy krople i niechętnie zwilża powierzchnie, zwłaszcza te tłuste. Cząsteczki mydła, dodane do wody, ustawiają się na granicy faz woda-powietrze, "rozrywając" siły spójności między cząsteczkami wody. Dzięki temu woda staje się bardziej "mokra", łatwiej penetruje zabrudzenia i lepiej zwilża czyszczoną powierzchnię.
Krok 2: Amfifilowa natura cząsteczek w akcji
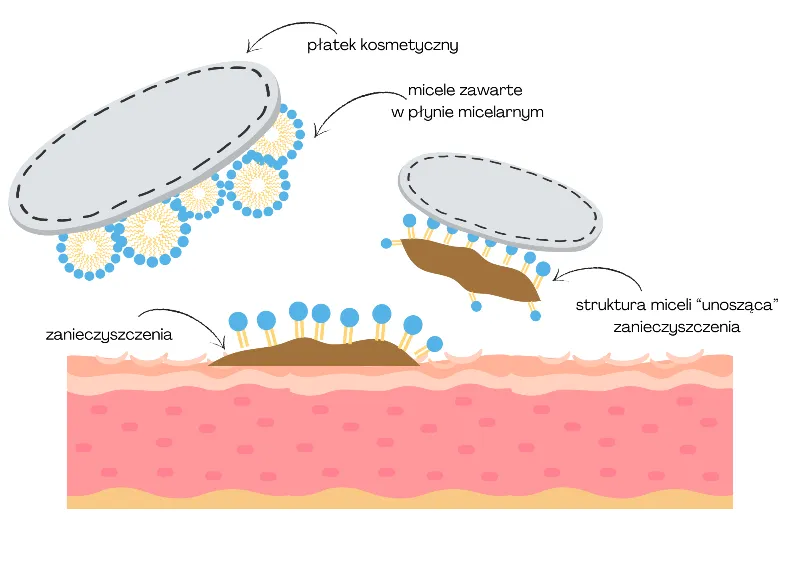
Gdy woda z mydłem zetknie się z brudem (który często ma charakter tłuszczowy), do akcji wkracza amfifilowa budowa cząsteczek mydła. Hydrofobowe "ogony" cząsteczek mydła, unikając wody, z łatwością wnikają w tłuste cząsteczki brudu. Jednocześnie hydrofilowe "głowy" pozostają na zewnątrz, zanurzone w wodzie. W ten sposób cząsteczki mydła działają jak "łącznik" między tłuszczem a wodą.
Krok 3: Formowanie miceli pułapek na cząsteczki brudu
W miarę jak coraz więcej cząsteczek mydła otacza cząsteczki brudu, tworzą się kuliste struktury zwane micelami. W miceli hydrofobowe ogony mydła otaczają i zamykają w sobie cząsteczki tłuszczu, tworząc "rdzeń" miceli. Hydrofilowe głowy natomiast tworzą zewnętrzną powłokę miceli, która jest skierowana ku wodzie. Dzięki temu micela z uwięzionym w środku brudem staje się rozpuszczalna w wodzie i może być łatwo odrywana od czyszczonej powierzchni, a następnie spłukiwana wraz z wodą. To właśnie ten proces emulgowania i zawieszania brudu w micelach jest sednem działania myjącego mydeł.
Jak piana pomaga w procesie mycia?
Często myślimy, że to piana jest odpowiedzialna za mycie, ale to nie do końca prawda. Piana, choć efektowna, nie usuwa brudu bezpośrednio. Jej rola jest bardziej pomocnicza. Przede wszystkim stabilizuje emulsję, czyli zawiesinę miceli z brudem w wodzie, zapobiegając ponownemu osadzaniu się zanieczyszczeń na czyszczonej powierzchni. Dodatkowo, obecność piany jest dla nas sygnałem, że w roztworze znajduje się wystarczająca ilość środka myjącego, co jest ważne z psychologicznego punktu widzenia.

Nie każde mydło jest takie samo: kluczowy podział i rodzaje
Choć podstawowy mechanizm działania mydła jest uniwersalny, to jednak nie wszystkie mydła są identyczne. Różnice w ich składzie chemicznym, zwłaszcza w rodzaju użytego kationu metalu, prowadzą do powstania wielu typów mydeł o odmiennych właściwościach i zastosowaniach.
Twarde czy miękkie? Rola kationu metalu w strukturze mydła
Najważniejszym czynnikiem decydującym o fizycznych właściwościach mydła, takich jak jego twardość i rozpuszczalność w wodzie, jest rodzaj kationu metalu. To właśnie on, łącząc się z anionem kwasu tłuszczowego, tworzy sól, którą nazywamy mydłem. Różne metale dają mydła o bardzo odmiennych cechach, co pozwala na ich różnorodne zastosowania.
Mydła sodowe: podstawa klasycznej kostki
Mydła sodowe to te, które najczęściej spotykamy w postaci twardych kostek. Powstają w wyniku zmydlania tłuszczów wodorotlenkiem sodu (NaOH). Są zazwyczaj białe lub lekko kremowe, dobrze rozpuszczalne w ciepłej wodzie i charakteryzują się dobrą pienistością. To właśnie mydła sodowe stanowią bazę dla większości mydeł toaletowych i gospodarczych w stałej formie.
Mydła potasowe: sekret szarego mydła i płynów do mycia
W przeciwieństwie do mydeł sodowych, mydła potasowe powstają przy użyciu wodorotlenku potasu (KOH). Są one znacznie bardziej miękkie, maziste i mają tendencję do bycia płynnymi lub półpłynnymi w temperaturze pokojowej. Klasycznym przykładem jest szare mydło, które zawdzięcza swoją konsystencję właśnie potasowi. Mydła potasowe są również bazą dla wielu mydeł w płynie, past do mycia rąk oraz niektórych środków piorących.
Mydła do zadań specjalnych: poznaj mydła nierozpuszczalne w wodzie
Oprócz dobrze znanych mydeł rozpuszczalnych w wodzie, istnieją również mydła, które w wodzie się nie rozpuszczają. Te nierozpuszczalne mydła, choć nie nadają się do mycia rąk, mają bardzo ważne zastosowania techniczne i przemysłowe, gdzie ich unikalne właściwości są niezwykle cenne.
Mydła litowe: niezbędny składnik smarów technicznych
Mydła litowe, powstające z kwasów tłuszczowych i wodorotlenku litu (LiOH), mają półciekłą konsystencję i są słabo rozpuszczalne w wodzie. Ich najważniejsze zastosowanie to produkcja smarów łożyskowych. Dzięki swoim właściwościom smarnym i odporności na wysokie temperatury, mydła litowe są kluczowym składnikiem wielu smarów technicznych, zapewniając płynną pracę maszyn i urządzeń.
Mydła magnezowe i wapniowe: główni winowajcy osadu z twardej wody
Mydła wapniowe i magnezowe powstają, gdy jony wapnia (Ca²⁺) i magnezu (Mg²⁺) obecne w twardej wodzie reagują z rozpuszczalnymi mydłami sodowymi lub potasowymi. Są one całkowicie nierozpuszczalne w wodzie i to właśnie one odpowiadają za powstawanie nieestetycznego osadu w wannie czy na umywalce, a także za słabsze pienienie się mydła w twardej wodzie. Co ciekawe, mydła magnezowe bywają jednak celowo dodawane do niektórych szamponów i płynów do kąpieli ze względu na ich właściwości kondycjonujące.
Mydła glinowe: jak zapewniają wodoodporność tkaninom?
Mydła glinowe, podobnie jak wapniowe i magnezowe, są nierozpuszczalne w wodzie. Ich unikalną właściwością jest zdolność do tworzenia wodoodpornych warstw. Z tego powodu znajdują zastosowanie w impregnacji tkanin, nadając im właściwości hydrofobowe. Są wykorzystywane do produkcji namiotów, plandek czy odzieży przeciwdeszczowej, gdzie kluczowa jest ochrona przed wilgocią.
Kluczowe właściwości mydeł, które musisz znać
Poza podziałem na rodzaje, mydła posiadają szereg innych istotnych właściwości chemicznych, które mają wpływ na ich skuteczność i interakcje z otoczeniem, w tym z naszą skórą.
Dlaczego roztwór mydła jest zasadowy? Zjawisko hydrolizy anionowej
Jedną z kluczowych właściwości mydeł sodowych i potasowych jest to, że ich wodne roztwory mają odczyn zasadowy. Dzieje się tak, ponieważ mydła są solami pochodzącymi od słabych kwasów (kwasów karboksylowych) i mocnych zasad (wodorotlenku sodu lub potasu). W wodzie anion kwasu tłuszczowego (-COO⁻) ulega hydrolizie anionowej, reagując z wodą i tworząc jony wodorotlenkowe (OH⁻), które podnoszą pH roztworu, nadając mu charakter zasadowy.
Mydło kontra twarda woda: dlaczego pieni się gorzej?
Wspomniałem już o tym, ale warto to podkreślić: twarda woda jest wrogiem mydła. Zawiera ona znaczne ilości jonów wapnia (Ca²⁺) i magnezu (Mg²⁺). Kiedy mydło (np. stearynian sodu) zetknie się z tymi jonami, następuje reakcja wymiany, w wyniku której powstają nierozpuszczalne w wodzie sole, takie jak stearynian wapnia czy stearynian magnezu. Te "nowe" mydła nie mają właściwości myjących, co powoduje, że mydło słabiej się pieni, a na powierzchniach tworzy się trudny do usunięcia, biały osad. To właśnie dlatego w twardej wodzie zużywamy więcej mydła, a efekty mycia są gorsze.
Jak mydła wpływają na pH naszej skóry?
Naturalne pH naszej skóry jest lekko kwaśne, oscylując wokół wartości 5,5. Ma to na celu ochronę przed rozwojem szkodliwych mikroorganizmów. Ze względu na swój zasadowy odczyn, tradycyjne mydła, zwłaszcza te w kostce, mogą zaburzać naturalną barierę kwasową skóry, prowadząc do jej wysuszenia i podrażnień. Dlatego też, w celu zminimalizowania tego efektu, w wielu nowoczesnych produktach do higieny osobistej stosuje się syntetyczne detergenty (syndety) o pH zbliżonym do pH skóry.
Odczyn i zastosowanie: od łazienki po przemysł
Różnorodność właściwości mydeł sprawia, że ich zastosowania wykraczają daleko poza codzienną higienę. Odgrywają one kluczową rolę zarówno w naszych domach, jak i w wielu gałęziach przemysłu.
Mydła toaletowe i lecznicze: jakie dodatki decydują o ich przeznaczeniu?
Mydła rozpuszczalne w wodzie, czyli głównie sodowe i potasowe, są powszechnie wykorzystywane w higienie osobistej (mydła toaletowe, szampony) oraz jako środki piorące. Ich podstawowym zadaniem jest usuwanie brudu i tłuszczu. Jednakże, w zależności od przeznaczenia, do mydeł dodaje się szereg substancji. Mydła toaletowe często zawierają substancje nawilżające, zapachowe, barwniki czy ekstrakty roślinne. Istnieją również mydła lecznicze, które wzbogaca się o składniki aktywne, takie jak siarka (stosowana w leczeniu trądziku) czy dziegieć (o właściwościach antyseptycznych i przeciwzapalnych).
Przeczytaj również: Model atomu na 5! Zbuduj go łatwo krok po kroku
Przemysłowe zastosowanie mydeł: gdzie jeszcze je znajdziemy?
Nierozpuszczalne mydła, takie jak litowe, glinowe, wapniowe czy magnezowe, mają szerokie zastosowanie w przemyśle. Jak już wspomniałem, mydła litowe są kluczowe w produkcji smarów. Mydła glinowe wykorzystuje się do impregnacji tkanin, nadając im właściwości wodoodporne. Mydła wapniowe i magnezowe, choć niepożądane w twardej wodzie, znajdują zastosowanie jako środki zagęszczające w niektórych produktach. To pokazuje, jak wszechstronne są te związki chemiczne i jak wiele ról odgrywają w naszym życiu, często pozostając niezauważonymi.

