Korozja to zjawisko, z którym spotykamy się na co dzień, choć często nie zdajemy sobie sprawy z jego chemicznego podłoża. Z perspektywy chemii, jest to fascynujący, lecz destrukcyjny proces utleniania-redukcji, który stopniowo niszczy materiały, zwłaszcza metale. Zrozumienie mechanizmów korozji jest absolutnie kluczowe dla każdego, kto interesuje się naukami ścisłymi, inżynierią materiałową, czy po prostu chce skutecznie chronić przed zniszczeniem wszystko, od karoserii samochodu po elementy infrastruktury.
Korozja to chemiczne niszczenie materiałów poznaj jej mechanizmy i rodzaje
- Korozja to stopniowe niszczenie materiałów, głównie metali, w wyniku reakcji chemicznych lub elektrochemicznych z otoczeniem.
- Z chemicznego punktu widzenia jest to proces utleniania-redukcji (redoks), prowadzący do degradacji materiału.
- Wyróżniamy korozję chemiczną (suchą, w wysokich temperaturach) oraz elektrochemiczną (najczęstszą, w obecności elektrolitu).
- Korozja elektrochemiczna polega na tworzeniu się ogniw galwanicznych na powierzchni metalu, gdzie metal utlenia się na anodzie.
- Czynniki takie jak wilgotność, sole, zanieczyszczenia powietrza, temperatura i kontakt różnych metali znacząco przyspieszają proces korozji.
- Skuteczne metody ochrony obejmują powłoki ochronne, ochronę katodową, inhibitory korozji oraz stosowanie materiałów pasywnych, np. stali nierdzewnej.
Czym jest korozja i dlaczego rdza to tylko wierzchołek góry lodowej
Korozja to nic innego jak stopniowe niszczenie materiałów, przede wszystkim metali i ich stopów, w wyniku ich reakcji chemicznych lub elektrochemicznych z otaczającym środowiskiem. Kiedy myślimy o korozji, często od razu przychodzi nam do głowy rdza. Jednak, jak zaraz wyjaśnię, rdza jest tylko specyficznym przykładem korozji żelaza, a samo zjawisko jest znacznie szersze i dotyczy wielu innych materiałów, w tym betonu czy tworzyw sztucznych, choć w tym artykule skupimy się na metalach. Z perspektywy chemii, korozja to proces utleniania-redukcji, czyli redoks, gdzie atomy metalu oddają elektrony, przechodząc w formę jonową, a tym samym ulegając degradacji.
Czy każda korozja to rdza? Wyjaśniamy podstawowe pojęcia
Absolutnie nie! Rdza to potoczna nazwa dla produktów korozji żelaza i jego stopów, głównie tlenków i wodorotlenków żelaza. Korozja natomiast to ogólne pojęcie opisujące degradację materiałów. W chemii rozróżniamy dwa podstawowe rodzaje korozji, które działają na nieco innych zasadach: korozję chemiczną i korozję elektrochemiczną. Z mojego doświadczenia wynika, że zrozumienie tej różnicy jest kluczowe do dalszego zgłębiania tematu. Korozja chemiczna to bezpośrednia reakcja materiału z agresywnym czynnikiem, podczas gdy korozja elektrochemiczna wymaga obecności elektrolitu i tworzenia się ogniw galwanicznych.
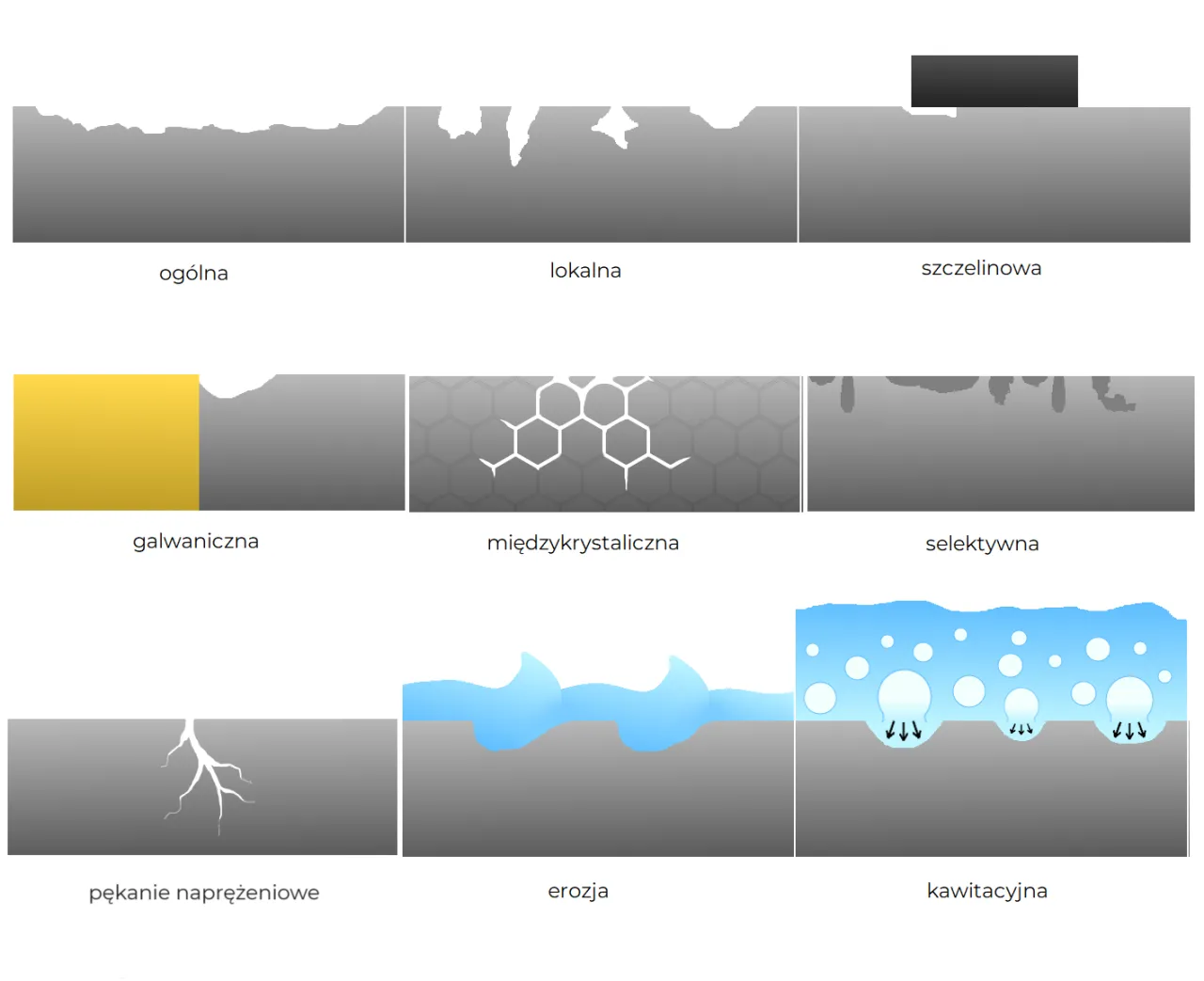
Dwa główne typy korozji: chemiczne i elektrochemiczne niszczenie materiałów
Korozja chemiczna: Gdy metal walczy na sucho i w wysokiej temperaturze
Korozja chemiczna, nazywana czasem "suchą", zachodzi w środowisku pozbawionym elektrolitu, zazwyczaj w wysokich temperaturach. Typowym przykładem jest utlenianie metali w suchym powietrzu, na przykład podczas obróbki cieplnej stali, gdzie na jej powierzchni tworzy się warstwa tlenków. Może również wystąpić w kontakcie z cieczami, które nie przewodzą prądu elektrycznego, takimi jak ciekła siarka. W tym przypadku atak korozyjny jest wynikiem bezpośredniej reakcji chemicznej między materiałem a agresywnym czynnikiem, bez udziału prądu elektrycznego czy przepływu jonów na większe odległości.
Korozja elektrochemiczna: Poznaj najczęstszego winowajcę niszczenia metali
Korozja elektrochemiczna to zdecydowanie najczęściej spotykany typ korozji w naszym codziennym otoczeniu. Występuje ona zawsze w obecności elektrolitu, czyli substancji przewodzącej prąd elektryczny dzięki ruchowi jonów najczęściej jest to woda z rozpuszczonymi w niej solami, kwasami czy zasadami. Proces ten polega na tworzeniu się na powierzchni metalu miniaturowych ogniw galwanicznych. W takim ogniwie wyróżniamy anodę, gdzie metal ulega utlenianiu i koroduje, oraz katodę, gdzie zachodzi reakcja redukcji, na przykład tlenu. To właśnie ten typ korozji odpowiada za rdzewienie samochodów, niszczenie mostów czy rurociągów.
Jak działa korozja elektrochemiczna: mechanizm niszczenia krok po kroku
Małe baterie na metalu: Czym są ogniwa korozyjne?
Wyobraźmy sobie powierzchnię metalu jako mozaikę, na której w wyniku różnic w składzie chemicznym, naprężeniach czy dostępie do tlenu, tworzą się mikroskopijne ogniwa galwaniczne. Te ogniwa korozyjne działają niczym miniaturowe baterie. Mają swoją anodę, katodę i elektrolit, a różnica potencjałów między nimi napędza przepływ elektronów, co z kolei prowadzi do niszczenia metalu. To właśnie te "małe baterie" są siłą napędową procesu rdzewienia i innych form korozji elektrochemicznej.
Anoda i katoda: Kto oddaje elektrony, a kto je przyjmuje w procesie rdzewienia?
W ogniwie korozyjnym role są jasno podzielone. Na anodzie metal ulega utlenianiu oddaje elektrony i przechodzi w formę jonową, co jest równoznaczne z jego korozją. To jest miejsce, gdzie materiał jest niszczony. Z kolei na katodzie zachodzi reakcja redukcji, czyli przyjęcia elektronów. W przypadku korozji żelaza w środowisku obojętnym lub zasadowym, najczęściej jest to redukcja tlenu. Elektrony, które metal oddał na anodzie, wędrują przez metal do katody, gdzie są "konsumowane" przez inne cząsteczki.
Rola elektrolitu: Dlaczego woda (zwłaszcza słona) jest największym sprzymierzeńcem rdzy?
Elektrolit jest absolutnie kluczowy w korozji elektrochemicznej. To on umożliwia przepływ jonów między anodą a katodą, zamykając tym samym obwód elektryczny ogniwa korozyjnego. Bez elektrolitu, proces korozji elektrochemicznej nie mógłby zachodzić. Woda, zwłaszcza ta zawierająca rozpuszczone sole, kwasy czy zasady, jest doskonałym elektrolitem. Obecność soli, na przykład chlorków z soli drogowej, drastycznie zwiększa przewodnictwo elektrolitu, co z kolei znacząco przyspiesza szybkość korozji. Dlatego właśnie samochody rdzewieją szybciej zimą, a konstrukcje morskie wymagają specjalnej ochrony.
Kluczowe reakcje chemiczne: Zapis, który wyjaśnia proces utleniania żelaza
Aby w pełni zrozumieć, jak działa korozja elektrochemiczna, warto przyjrzeć się kluczowym reakcjom chemicznym, które zachodzą na anodzie i katodzie, szczególnie w przypadku rdzewienia żelaza:
-
Reakcja anodowa (utlenianie metalu): Na anodzie żelazo oddaje elektrony, przechodząc w jony żelaza(II):
Fe → Fe²⁺ + 2e⁻
-
Reakcja katodowa (redukcja tlenu w środowisku obojętnym lub zasadowym): W obecności wody i tlenu, elektrony są przyjmowane przez tlen, tworząc jony wodorotlenkowe:
O₂ + 2H₂O + 4e⁻ → 4OH⁻
-
Reakcja katodowa (redukcja tlenu w środowisku kwaśnym): W kwaśnym środowisku tlen redukuje się, tworząc wodę:
O₂ + 4H⁺ + 4e⁻ → 2H₂O
Te reakcje są podstawą procesu, który ostatecznie prowadzi do powstania dobrze nam znanej rdzy.
Co przyspiesza korozję? Czynniki napędzające niszczenie metali
Wpływ wilgoci i tlenu: Niezbędny duet do powstania rdzy
Jak już wspomniałem, wilgotność, czyli obecność wody, jest niezbędna w procesie korozji elektrochemicznej, ponieważ działa jako elektrolit. Bez niej przepływ jonów byłby niemożliwy. Równie ważny jest tlen, który pełni rolę akceptora elektronów na katodzie. To właśnie ten duet woda i tlen jest głównym motorem napędowym dla większości procesów korozji metali, szczególnie żelaza. Im więcej wilgoci i tlenu, tym szybciej metal ulega zniszczeniu.
Sól drogowa i kwaśne deszcze: Jak zanieczyszczenia środowiska przyspieszają katastrofę?
Obecność soli, zwłaszcza chlorków pochodzących z soli drogowej, ma dramatyczny wpływ na szybkość korozji. Jony chlorkowe znacząco zwiększają przewodnictwo elektrolitu, co sprawia, że proces elektrochemiczny zachodzi znacznie szybciej. Dlatego też karoserie samochodów tak szybko rdzewieją zimą. Podobnie szkodliwe są zanieczyszczenia powietrza, takie jak tlenki siarki (SO₂) i tlenki azotu (NOx). Reagują one z wodą w atmosferze, tworząc kwasy (znane jako kwaśne deszcze), które są silnie korozyjne i atakują metale, przyspieszając ich degradację.
Temperatura i naprężenia: Ukryci wrogowie trwałości materiałów
Temperatura odgrywa istotną rolę w procesach korozyjnych. Z reguły, wyższa temperatura przyspiesza szybkość reakcji chemicznych, w tym tych odpowiedzialnych za korozję. Dlatego też elementy pracujące w podwyższonych temperaturach są bardziej narażone na zniszczenie. Co więcej, naprężenia mechaniczne w materiale również mogą być ukrytym wrogiem. Obszary metalu poddane naprężeniom (np. zgięcia, spoiny) często mają niższy potencjał elektrochemiczny i stają się preferencyjnymi anodami, co oznacza, że korodują w przyspieszonym tempie. To zjawisko nazywamy korozją naprężeniową.
Kontakt różnych metali: Pułapka galwaniczna, czyli dlaczego nie łączyć miedzi ze stalą?
Jednym z najczęstszych błędów w projektowaniu i montażu jest łączenie ze sobą różnych metali w obecności elektrolitu. Tworzy się wtedy ogniwo galwaniczne, w którym metal mniej szlachetny (o niższym potencjale elektrochemicznym) staje się anodą i koroduje w przyspieszonym tempie, "poświęcając się" dla ochrony metalu bardziej szlachetnego. Klasycznym przykładem jest łączenie miedzi ze stalą. Miedź jest metalem szlachetniejszym niż stal, więc w kontakcie z nią, stal będzie intensywnie korodować. Zawsze zwracam na to uwagę w moich projektach unikanie pułapek galwanicznych to podstawa.
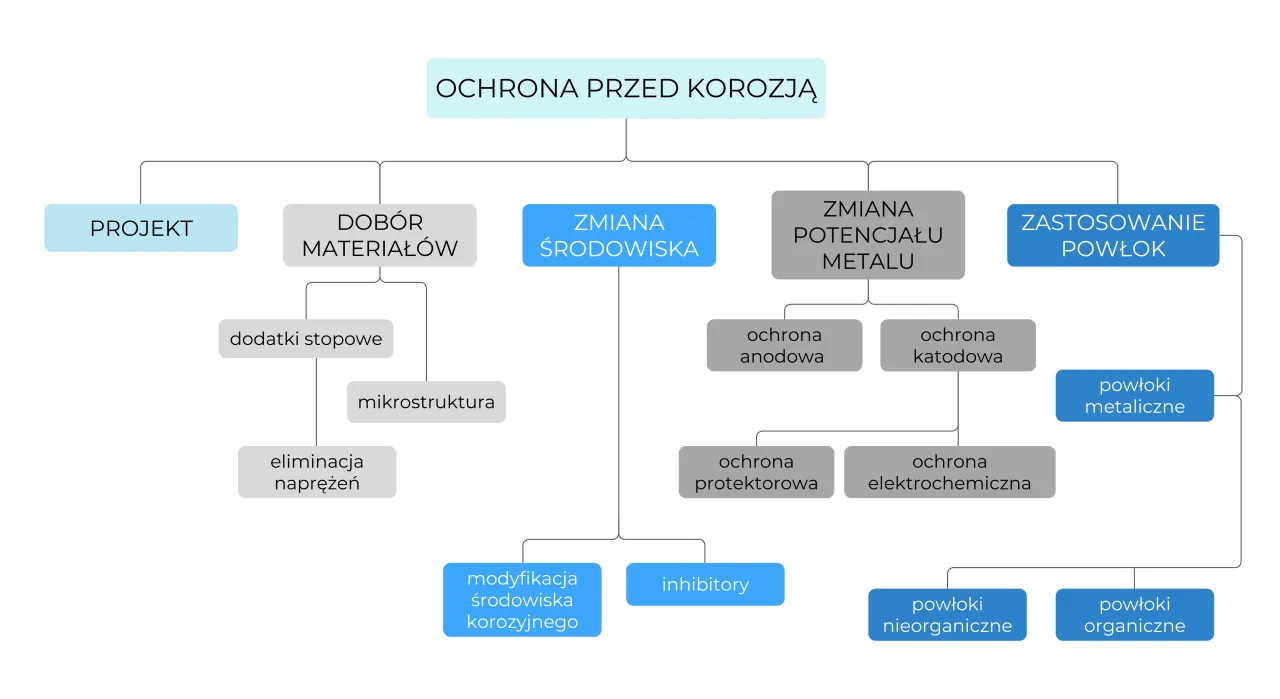
Skuteczne metody ochrony przed korozją: tarcza dla metalu
Izolacja od wroga: Jak działają powłoki malarskie, lakiery i tworzywa sztuczne?
Jedną z najprostszych i najczęściej stosowanych metod ochrony przed korozją jest izolacja metalu od środowiska korozyjnego. Służą do tego różnego rodzaju powłoki ochronne. Powłoki organiczne, takie jak farby, lakiery czy tworzywa sztuczne, tworzą fizyczną barierę na powierzchni metalu, uniemożliwiając kontakt z wilgocią i tlenem. Ważne jest, aby taka powłoka była szczelna i nieuszkodzona, ponieważ nawet niewielkie pęknięcie może stać się miejscem inicjacji korozji.
Poświęcenie dla ochrony: Na czym polega cynkowanie i chromowanie?
Powłoki metaliczne to kolejna skuteczna metoda. Cynkowanie to proces pokrywania stali warstwą cynku. Cynk jest metalem mniej szlachetnym niż żelazo, więc w przypadku uszkodzenia powłoki, to on staje się anodą i koroduje, chroniąc żelazo. Mówimy wtedy o ochronie protektorowej. Chromowanie natomiast, polegające na pokryciu metalu warstwą chromu, działa inaczej. Chrom tworzy na swojej powierzchni pasywną warstwę tlenków, która jest niezwykle odporna na korozję i stanowi barierę ochronną.
Ochrona katodowa i protektorowa: Genialny sposób na odwrócenie ról w ogniwie korozyjnym
Ochrona katodowa to moim zdaniem jeden z najbardziej genialnych sposobów walki z korozją. Polega ona na tym, aby chroniona konstrukcja stała się katodą ogniwa galwanicznego, co oznacza, że to nie ona będzie oddawać elektrony i korodować. Można to osiągnąć na dwa główne sposoby: poprzez zastosowanie anody protektorowej (np. bloczków magnezu lub cynku, które "poświęcają się" i korodują zamiast chronionego metalu) lub przez przyłożenie zewnętrznego źródła prądu stałego, które wymusza przepływ elektronów w odpowiednim kierunku. Jest to metoda szeroko stosowana do ochrony rurociągów, statków czy zbiorników podziemnych.
Magia stali nierdzewnej: Czym jest pasywacja i dlaczego chrom jest tak ważny?
Stal nierdzewna to przykład materiału, który zawdzięcza swoją odporność na korozję zjawisku pasywacji. Stopy żelaza z chromem (i często niklem) tworzą na swojej powierzchni niezwykle cienką, ale szczelną i stabilną warstwę tlenków chromu. Ta warstwa, choć niewidoczna, izoluje metal od środowiska korozyjnego i zapobiega dalszej korozji. Chrom jest tutaj kluczowy, ponieważ to on tworzy tę ochronną barierę. Dzięki pasywacji stal nierdzewna jest tak szeroko stosowana w przemyśle spożywczym, medycynie czy architekturze.
Inhibitory: Chemiczni strażnicy spowalniający proces korozji
Inhibitory korozji to substancje chemiczne, które dodaje się do środowiska korozyjnego w niewielkich ilościach, aby spowolnić lub całkowicie zahamować proces korozji. Działają one na różne sposoby mogą tworzyć warstwę ochronną na powierzchni metalu, zmieniać skład elektrolitu lub wpływać na reakcje anodowe lub katodowe. Są one powszechnie stosowane na przykład w układach chłodzenia samochodów, gdzie chronią elementy silnika przed rdzewieniem, czy w przemyśle naftowym i gazowym do ochrony rurociągów.
Korozja w praktyce: znaczenie chemii w ochronie przed zniszczeniem
Od karoserii samochodu po mosty: Skutki korozji w życiu codziennym i przemyśle
Skutki korozji są wszechobecne i mają ogromne znaczenie zarówno w naszym życiu codziennym, jak i w przemyśle. Widzimy ją na karoseriach samochodów, elementach ogrodzeń, narzędziach, a także w znacznie większej skali na mostach, rurociągach, platformach wiertniczych czy konstrukcjach budowlanych. Korozja prowadzi nie tylko do strat estetycznych, ale przede wszystkim do osłabienia konstrukcji, awarii maszyn i urządzeń, a w konsekwencji do ogromnych strat ekonomicznych i zagrożeń dla bezpieczeństwa. Koszty związane z naprawą i wymianą skorodowanych elementów idą w miliardy dolarów rocznie na całym świecie.
Przeczytaj również: Jaka chemia do jacuzzi ogrodowego? Poradnik czystej i bezpiecznej wody
Dlaczego zrozumienie chemii korozji jest kluczowe dla inżynierów i technologów?
Dla mnie, jako eksperta w tej dziedzinie, dogłębne zrozumienie chemicznych aspektów korozji jest absolutnie fundamentalne dla inżynierów i technologów. Tylko dzięki tej wiedzy możemy świadomie dobierać odpowiednie materiały do konkretnych zastosowań, projektować konstrukcje w sposób minimalizujący ryzyko korozji oraz opracowywać i wdrażać skuteczne metody ochrony. To pozwala nam nie tylko zapewnić trwałość i bezpieczeństwo infrastruktury i produktów, ale także optymalizować koszty i dbać o środowisko. Bez chemii korozji, nasze osiągnięcia technologiczne byłyby znacznie mniej trwałe i niezawodne.

