Zastanawiasz się, jak obliczyć ładunek atomu, który stał się jonem? To jedno z fundamentalnych pytań w chemii, które pozwala zrozumieć, dlaczego pierwiastki reagują ze sobą w określony sposób. W tym artykule przeprowadzimy Cię krok po kroku przez proces powstawania jonów i metody obliczania ich ładunku, abyś bez problemu radził sobie z tego typu zadaniami.
Obliczanie ładunku jonu klucz do zrozumienia, jak atomy zyskują i tracą elektrony
- Atom w stanie obojętnym ma równą liczbę protonów i elektronów, a jego ładunek wynosi zero.
- Jon powstaje, gdy atom oddaje (kation, ładunek dodatni) lub przyjmuje (anion, ładunek ujemny) elektrony.
- Ładunek jonu jest wielokrotnością ładunku elementarnego i zależy od liczby oddanych lub przyjętych elektronów.
- Utrata elektronów (cząstek ujemnych) prowadzi do uzyskania ładunku dodatniego.
- Przyjęcie elektronów (cząstek ujemnych) prowadzi do uzyskania ładunku ujemnego.
- Ładunek jonu można obliczyć wzorem: (Liczba protonów) - (Liczba elektronów po zmianie).
Zrozumieć atom: Dlaczego ładunek jest kluczowy w chemii?
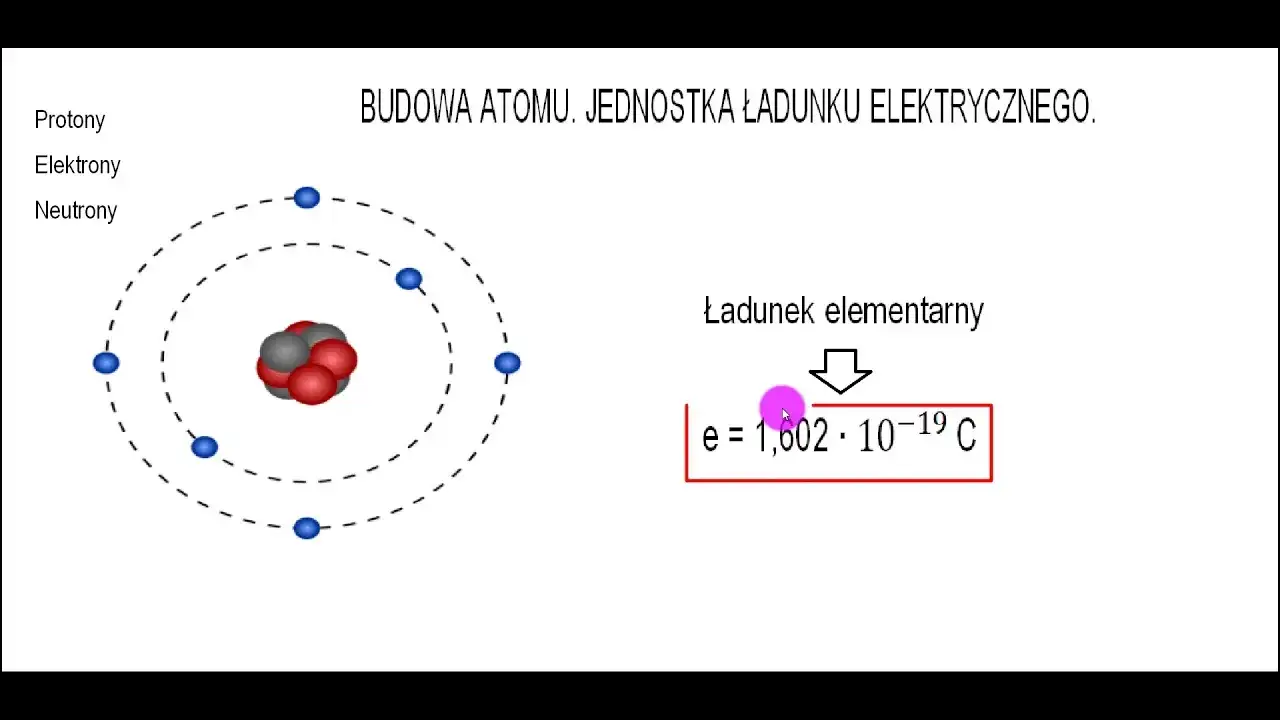
Punkt wyjścia: Czym jest elektrycznie obojętny atom?
Zacznijmy od podstaw. Atom w swoim naturalnym, czyli elektrycznie obojętnym stanie, jest idealnie zbalansowany. Oznacza to, że ma dokładnie taką samą liczbę cząstek dodatnich protonów, które znajdują się w jego jądrze jak i cząstek ujemnych elektronów, krążących wokół jądra na powłokach elektronowych. Proton ma ładunek +1 (ładunek elementarny), a elektron ładunek -1. Dzięki tej równowadze sumaryczny ładunek atomu wynosi zero.
Protony kontra elektrony: odwieczna walka o równowagę ładunku.
W jądrze atomu protony są "uwięzione" i ich liczba jest stała dla danego pierwiastka to właśnie liczba protonów definiuje, z jakim pierwiastkiem mamy do czynienia. Elektrony natomiast, choć przyciągane przez dodatnio naładowane jądro, są znacznie bardziej ruchliwe i mogą być oddawane lub przyjmowane przez atom. Ta dynamika między stałą liczbą protonów a zmienną liczbą elektronów jest kluczowa dla zrozumienia, jak atomy zyskują ładunek elektryczny i tworzą wiązania chemiczne.Kiedy atom przestaje być obojętny? Wprowadzenie do pojęcia jonu.
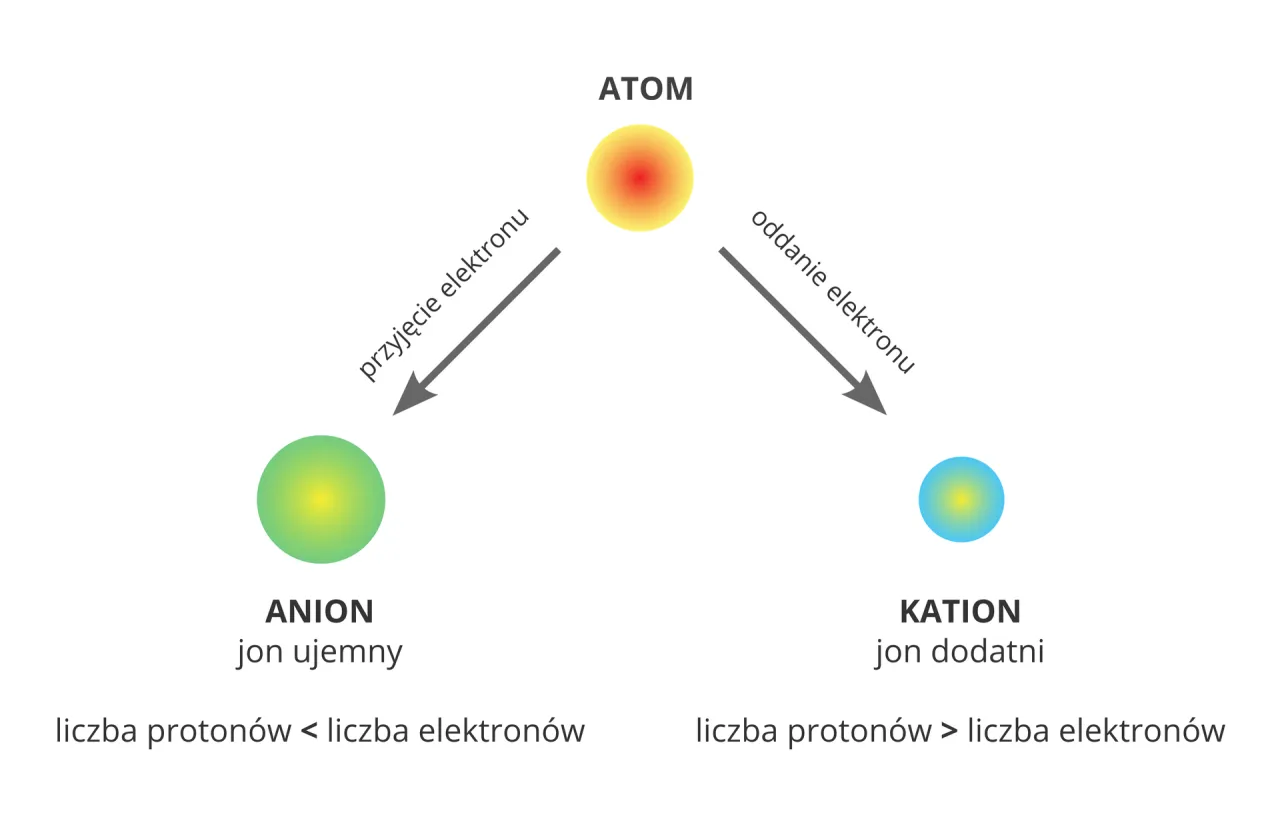
Atom przestaje być elektrycznie obojętny, gdy zakłócona zostanie równowaga między liczbą protonów a elektronów. Wtedy mówimy o jony atomie lub grupie atomów, która posiada nadmiar lub niedobór elektronów i w efekcie ma ładunek elektryczny. W zależności od tego, czy atom oddał, czy przyjął elektrony, wyróżniamy dwa typy jonów:
- Kation: To jon o ładunku dodatnim. Powstaje, gdy atom oddaje jeden lub więcej elektronów. Wówczas liczba protonów w jądrze staje się większa niż liczba elektronów na powłokach.
- Anion: To jon o ładunku ujemnym. Powstaje, gdy atom przyjmuje jeden lub więcej elektronów. W tym przypadku liczba elektronów przewyższa liczbę protonów.
Jak obliczyć ładunek atomu: Dwa kluczowe scenariusze
Scenariusz 1: Atom oddaje elektrony jak powstaje ładunek dodatni (kation)?
Kiedy atom oddaje elektrony, pozbywa się cząstek o ładunku ujemnym. Wyobraź sobie, że masz portfel, w którym każda złotówka to proton (+1), a każdy dług to elektron (-1). Jeśli pozbędziesz się długu (elektronu), Twoje saldo (ładunek) automatycznie staje się bardziej dodatnie. Na przykład, atom sodu (Na) w stanie obojętnym ma 11 protonów i 11 elektronów. Jeśli odda 1 elektron, będzie miał nadal 11 protonów, ale już tylko 10 elektronów. Przewaga protonów (+11) nad elektronami (-10) daje sumaryczny ładunek +1. Powstaje wtedy kation sodu, oznaczany jako Na⁺.
Scenariusz 2: Atom przyjmuje elektrony droga do ładunku ujemnego (anion).
Z kolei, gdy atom przyjmuje elektrony, zyskuje dodatkowe cząstki o ładunku ujemnym. Wracając do analogii z portfelem: jeśli zaciągniesz nowy dług (przyjmiesz elektron), Twoje saldo (ładunek) stanie się bardziej ujemne. Przykładem może być atom chloru (Cl), który w stanie obojętnym ma 17 protonów i 17 elektronów. Jeśli przyjmie 1 elektron, liczba protonów pozostanie 17, ale liczba elektronów wzrośnie do 18. Przewaga elektronów (-18) nad protonami (+17) daje sumaryczny ładunek -1. Powstaje wtedy anion chlorkowy, oznaczany jako Cl⁻.
Złota zasada: utrata "minusa" daje "plus", a zysk "minusa" daje "minus".
To jest moim zdaniem najważniejsza zasada, którą musisz sobie przyswoić, bo często bywa mylona. Wielu uczniów intuicyjnie myśli, że "oddanie" czegoś to "minus", a "przyjęcie" to "plus". Jednak w przypadku elektronów jest dokładnie odwrotnie! Utrata elektronów (które są ujemne) prowadzi do ładunku dodatniego, ponieważ pozbywamy się "minusów". Z kolei przyjęcie elektronów (dodatkowych "minusów") prowadzi do ładunku ujemnego. Pamiętaj o tym, a unikniesz wielu błędów.
Pamiętaj: Utrata cząstki ujemnej (elektronu) zawsze prowadzi do ładunku dodatniego, natomiast zyskanie cząstki ujemnej (elektronu) prowadzi do ładunku ujemnego.
Metoda obliczeniowa krok po kroku: Obliczanie ładunku jonu bez pomyłek
Krok 1: Określ, czy elektrony zostały oddane, czy przyjęte.
Pierwszym krokiem jest zawsze zrozumienie, co dzieje się z elektronami. Czy atom pozbywa się elektronów, czy też je do siebie przyciąga? To kluczowa informacja, która zadecyduje o znaku ładunku jonu.
Krok 2: Policz, ile elektronów zmieniło swoje miejsce.
Następnie musisz dokładnie określić liczbę elektronów, które zostały oddane lub przyjęte. Ta liczba będzie odpowiadać wartości liczbowej ładunku jonu. Na przykład, jeśli atom oddał dwa elektrony, wartość ładunku będzie wynosić 2.
Krok 3: Przypisz znak (+ lub -) i wartość liczbową do ładunku.
Mając już liczbę zmienionych elektronów i wiedząc, czy zostały oddane, czy przyjęte, możesz przypisać odpowiedni znak. Jeśli elektrony zostały oddane, ładunek będzie dodatni (+). Jeśli zostały przyjęte, ładunek będzie ujemny (-). Wartość liczbowa będzie odpowiadać liczbie elektronów z poprzedniego kroku. Na przykład, oddanie 2 elektronów daje ładunek +2, a przyjęcie 1 elektronu daje ładunek -1.
Prosty wzór, który zawsze działa: Ładunek = (liczba protonów) (nowa liczba elektronów).
Jeśli wolisz bardziej formalne podejście, możesz zastosować uniwersalny wzór, który zawsze pozwoli Ci obliczyć ładunek jonu. Pamiętaj, że liczba protonów jest stała dla danego pierwiastka i znajdziesz ją w układzie okresowym (liczba atomowa Z). Wzór wygląda następująco:Ładunek jonu = (Liczba protonów) - (Liczba elektronów po zmianie)
Stosując ten wzór, automatycznie uzyskasz prawidłowy znak ładunku. Na przykład, jeśli atom ma 11 protonów i po oddaniu elektronu ma 10 elektronów, obliczenie to 11 - 10 = +1. Jeśli ma 17 protonów i po przyjęciu elektronu ma 18 elektronów, obliczenie to 17 - 18 = -1.
Przykłady z życia szkolnego: Rozwiązujemy typowe zadania z ładunkiem jonu
Przykład 1: Oblicz ładunek atomu sodu (Na), który oddał jeden elektron.
- Atom sodu (Na) w stanie obojętnym ma 11 protonów i 11 elektronów (liczba atomowa Z=11).
- Atom oddał 1 elektron.
- Nowa liczba elektronów to 11 - 1 = 10.
- Stosujemy wzór: Ładunek = (Liczba protonów) - (Nowa liczba elektronów) = 11 - 10 = +1.
Atom sodu uzyska ładunek +1 i powstanie kation Na⁺.
Przykład 2: Oblicz ładunek atomu siarki (S), który przyjął dwa elektrony.
- Atom siarki (S) w stanie obojętnym ma 16 protonów i 16 elektronów (liczba atomowa Z=16).
- Atom przyjął 2 elektrony.
- Nowa liczba elektronów to 16 + 2 = 18.
- Stosujemy wzór: Ładunek = (Liczba protonów) - (Nowa liczba elektronów) = 16 - 18 = -2.
Atom siarki uzyska ładunek -2 i powstanie anion S²⁻.
Przykład 3: Jaki ładunek uzyska atom glinu (Al) po utracie trzech elektronów walencyjnych?
- Atom glinu (Al) w stanie obojętnym ma 13 protonów i 13 elektronów (liczba atomowa Z=13).
- Atom utracił (oddał) 3 elektrony.
- Nowa liczba elektronów to 13 - 3 = 10.
- Stosujemy wzór: Ładunek = (Liczba protonów) - (Nowa liczba elektronów) = 13 - 10 = +3.
Atom glinu uzyska ładunek +3 i powstanie kation Al³⁺.
Najczęstsze pułapki i błędy: Jak ich skutecznie unikać
Błąd #1: Mylenie znaku ładunku dlaczego oddawanie to nie minus?
To, co często widzę u moich uczniów, to mylenie znaku ładunku. Intuicja podpowiada, że "oddanie" to "minus", a "przyjęcie" to "plus". Pamiętaj jednak, że elektrony niosą ładunek ujemny. Zatem, jeśli atom oddaje elektrony, to pozbywa się "minusów", a to sprawia, że jego ładunek staje się bardziej dodatni. Jeśli atom przyjmuje elektrony, to "dokłada" sobie "minusów", co sprawia, że jego ładunek staje się bardziej ujemny. Zawsze myśl o elektronach jako o "ujemnych" cząstkach pozbycie się ujemnych cząstek daje ładunek dodatni, a zyskanie ujemnych cząstek daje ładunek ujemny.
Błąd #2: Niepoprawny zapis jonu (np. 2+Mg zamiast Mg²⁺).
Prawidłowy zapis jonów jest bardzo ważny i świadczy o Twojej precyzji. Ładunek jonu zawsze zapisujemy po symbolu pierwiastka, w indeksie górnym. Najpierw podajemy wartość liczbową, a potem znak. Na przykład, kation magnezu, który oddał dwa elektrony, zapisujemy jako Mg²⁺, a nie Mg+2 czy 2+Mg. Jeśli ładunek wynosi +1 lub -1, cyfrę "1" zazwyczaj pomijamy, pisząc po prostu Na⁺ zamiast Na¹⁺, czy Cl⁻ zamiast Cl¹⁻. To standardowy zapis, którego musisz się trzymać.
Błąd #3: Zapominanie, że zmienia się tylko liczba elektronów, a nie protonów.
W procesie tworzenia jonów kluczowe jest to, że zmienia się wyłącznie liczba elektronów. Liczba protonów w jądrze atomowym pozostaje niezmienna! To właśnie liczba protonów decyduje o tym, jaki to pierwiastek chemiczny. Jeśli zmieniłaby się liczba protonów, mielibyśmy do czynienia z innym pierwiastkiem, a nie z jonem tego samego pierwiastka. Zawsze zakładaj, że liczba protonów jest stała i niezmienna dla danego atomu, który staje się jonem.
Przeczytaj również: Czy można zobaczyć atom? Jak naukowcy "widzą" niewidzialne.
Dlaczego atomy oddają lub przyjmują elektrony: Szybkie spojrzenie na regułę oktetu
Dążenie do stabilności chemiczny cel każdego atomu.
Z mojego doświadczenia wiem, że zrozumienie "dlaczego" jest równie ważne, jak "jak". Atomy oddają lub przyjmują elektrony, ponieważ dążą do osiągnięcia stabilnej konfiguracji elektronowej. Najczęściej jest to tzw. reguła oktetu, czyli posiadanie ośmiu elektronów na najbardziej zewnętrznej powłoce walencyjnej (z wyjątkiem atomów z pierwszej i drugiej grupy, które dążą do dubletu, czyli dwóch elektronów, jak hel). Taka konfiguracja jest energetycznie najkorzystniejsza i sprawia, że atom jest stabilny, podobnie jak gazy szlachetne.
Jak układ okresowy pierwiastków podpowiada, jaki ładunek przyjmie atom?
Układ okresowy pierwiastków to prawdziwa skarbnica wiedzy! Położenie pierwiastka w układzie często podpowiada, jaki ładunek prawdopodobnie przyjmie. Na przykład, pierwiastki z 1. grupy (np. sód, potas) mają jeden elektron walencyjny, który łatwo oddają, tworząc kationy o ładunku +1. Pierwiastki z 17. grupy (np. chlor, fluor) mają siedem elektronów walencyjnych i do oktetu brakuje im jednego elektronu, więc chętnie go przyjmują, tworząc aniony o ładunku -1. To pokazuje, że chemia nie jest przypadkowa wszystko ma swoją logiczną przyczynę.