Atom to coś więcej niż tylko abstrakcyjne pojęcie z podręczników chemii czy fizyki. To fundamentalny budulec wszystkiego, co nas otacza od najmniejszej cząsteczki wody po gwiazdy i galaktyki. Zrozumienie jego budowy to klucz do poznania, jak działa świat na najbardziej podstawowym poziomie i dlaczego materia zachowuje się w taki, a nie inny sposób.
Atom składa się z jądra i elektronów poznaj jego podstawowe cząstki i zasady budowy.
- Atom jest podstawowym składnikiem materii, złożonym z dodatnio naładowanego jądra i ujemnie naładowanych elektronów.
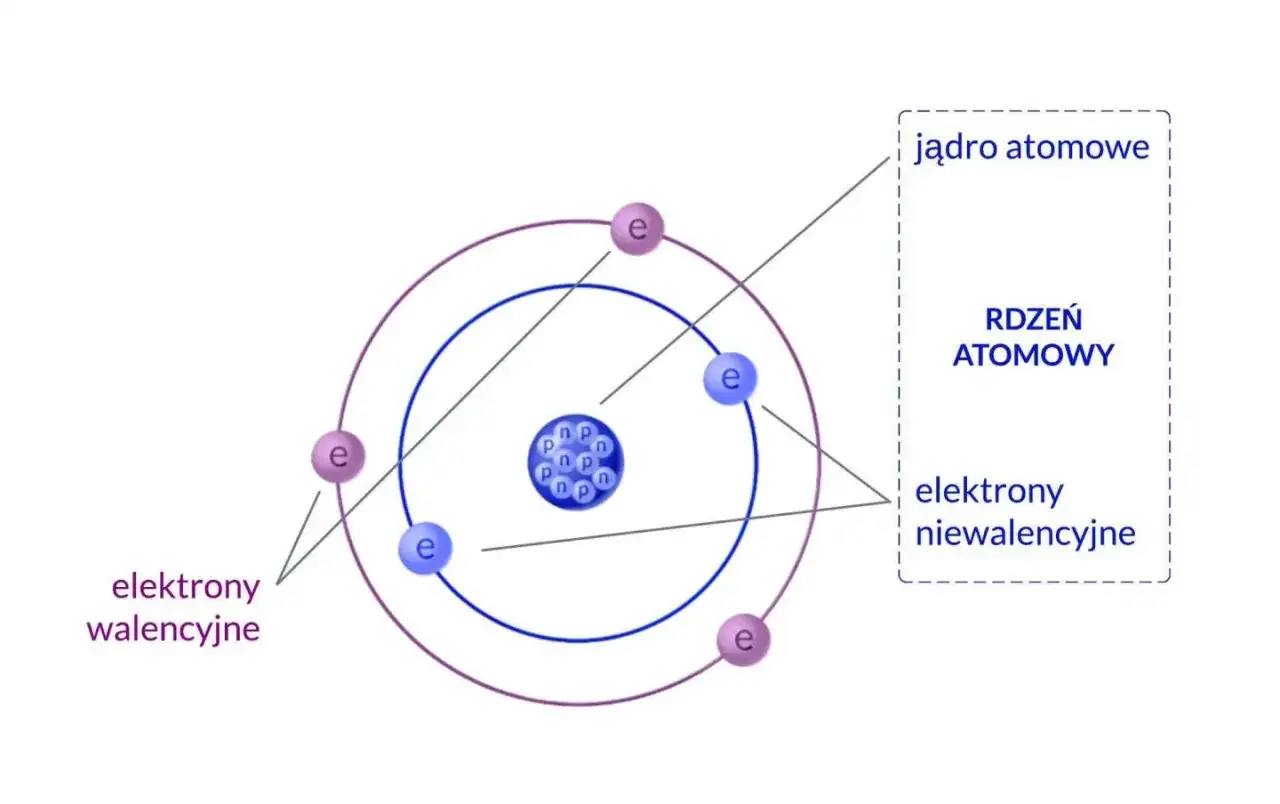
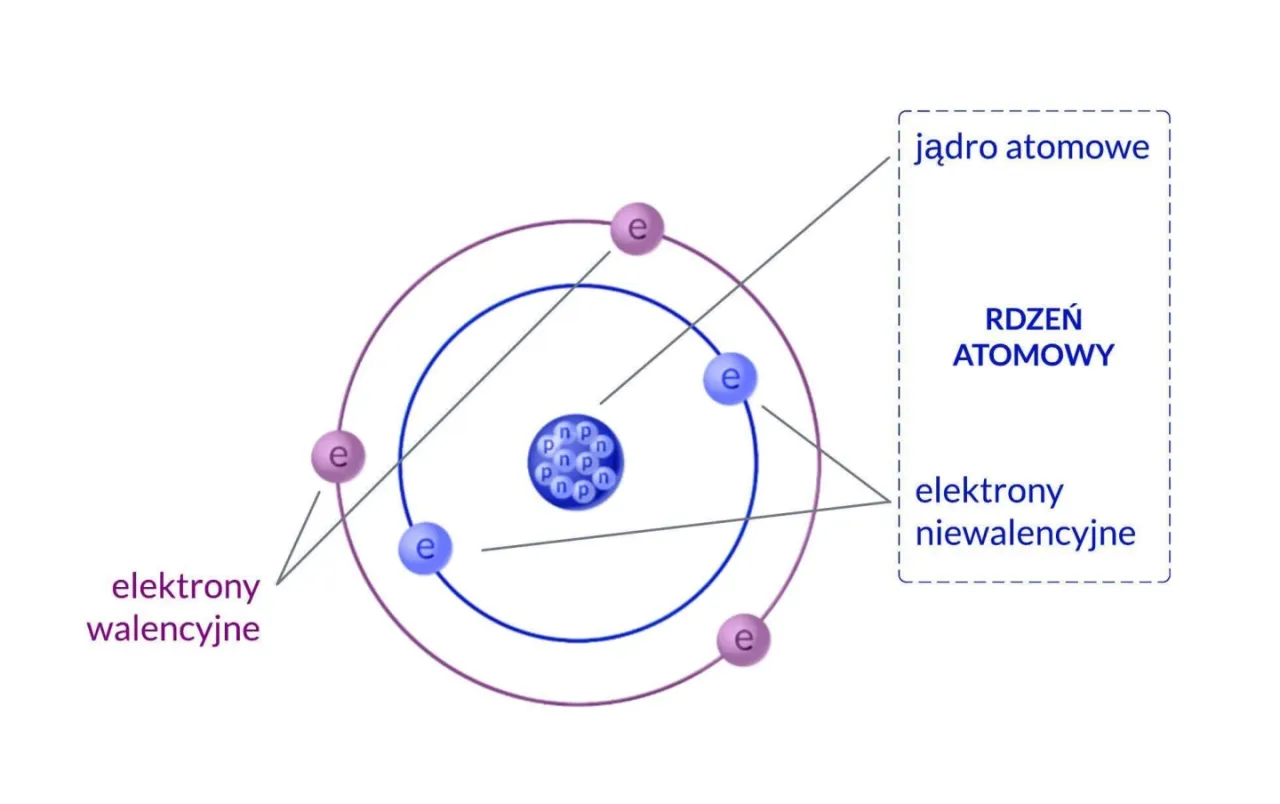
- Jądro atomowe, niezwykle małe i gęste, zawiera protony (ładunek dodatni) i neutrony (obojętne elektrycznie).
- Elektrony krążą wokół jądra w określonych obszarach zwanych powłokami elektronowymi.
- Liczba protonów (liczba atomowa Z) jest unikalna dla każdego pierwiastka i określa jego tożsamość.
- Elektrony walencyjne, znajdujące się na najbardziej zewnętrznej powłoce, decydują o właściwościach chemicznych atomu.
- Współczesny model atomu opisuje elektrony jako chmurę prawdopodobieństwa, a nie cząstki na stałych orbitach.
Atom: podstawowy budulec materii
Kiedy mówimy o atomie, myślimy o najmniejszej cząstce pierwiastka chemicznego, która zachowuje jego właściwości. Wyobraźmy sobie go jako miniaturowy układ słoneczny, choć ta analogia, jak się później przekonamy, ma swoje ograniczenia. W centrum atomu znajduje się jądro atomowe niezwykle małe, gęste i dodatnio naładowane. To właśnie tam skupiona jest praktycznie cała masa atomu, ponad 99,9%!
Wokół tego gęstego jądra, w ogromnej przestrzeni, krążą ujemnie naładowane cząstki, które nazywamy elektronami. Tworzą one coś, co często określa się mianem chmury elektronowej. Elektrony mają masę tak znikomą w porównaniu do jądra, że często jest ona pomijana w obliczeniach mas atomowych. Ta struktura małe, ciężkie jądro otoczone lekkimi, wirującymi elektronami jest fundamentalna dla zrozumienia chemii i fizyki.
Trzy filary atomu: poznaj jego elementarne cząstki
Aby w pełni zrozumieć, jak zbudowany jest atom i dlaczego zachowuje się w określony sposób, musimy przyjrzeć się jego trzem podstawowym składnikom. To właśnie te elementarne cząstki protony, neutrony i elektrony są fundamentem, na którym opiera się cała materia, a ich właściwości decydują o tożsamości i reaktywności każdego pierwiastka.
Protony (p+): strażnicy tożsamości pierwiastka
Protony to cząstki, które znajdziemy w samym sercu atomu, czyli w jądrze atomowym. Każdy proton niesie ze sobą dodatni ładunek elektryczny (+1). Ich rola jest absolutnie kluczowa, ponieważ to właśnie liczba protonów w jądrze decyduje o tym, z jakim pierwiastkiem chemicznym mamy do czynienia. Ta liczba nazywana jest liczbą atomową (Z) i jest niczym unikalny dowód osobisty dla każdego atomu. Jeśli atom ma 6 protonów, zawsze będzie to atom węgla, niezależnie od liczby neutronów czy elektronów.Neutrony (n⁰): cisi gracze wpływający na masę
Obok protonów, w jądrze atomowym rezydują również neutrony. Jak sama nazwa wskazuje, są to cząstki obojętne elektrycznie (ładunek 0). Ich obecność jest jednak niezwykle ważna, ponieważ razem z protonami tworzą tzw. nukleony, czyli składniki jądra. Neutrony w znaczący sposób przyczyniają się do masy atomu. Co ciekawe, atomy tego samego pierwiastka (czyli mające tę samą liczbę protonów) mogą różnić się liczbą neutronów. Takie "odmiany" nazywamy izotopami. To właśnie neutrony są odpowiedzialne za różnice w masie między izotopami.
Elektrony (e⁻): wirujące nośniki energii i ładunku
Elektrony to trzeci i ostatni typ elementarnych cząstek budujących atom. W przeciwieństwie do protonów i neutronów, elektrony mają ujemny ładunek elektryczny (-1) i są niezwykle lekkie ich masa jest około 1836 razy mniejsza niż masa protonu. Krążą one wokół jądra atomowego w określonych obszarach. W atomie, który jest obojętny elektrycznie, liczba elektronów jest zawsze równa liczbie protonów. Dzięki temu dodatnie ładunki protonów są zrównoważone przez ujemne ładunki elektronów, co sprawia, że atom jako całość nie ma ładunku netto.Jądro atomowe: centrum wszechświata w miniaturze
Jądro atomowe to prawdziwe serce atomu, jego grawitacyjne i elektryczne centrum. Jest to ta centralna, dodatnio naładowana część, która, jak już wspomniałem, skupia w sobie niemal całą masę atomu. Jego rola jest absolutnie fundamentalna nie tylko decyduje o tożsamości pierwiastka poprzez liczbę protonów, ale także o jego stabilności. Bez stabilnego jądra nie byłoby stabilnych atomów, a co za tym idzie stabilnej materii, którą znamy.
Dlaczego jądro jest tak małe, a jednocześnie tak ciężkie?
To jedno z najbardziej fascynujących pytań dotyczących atomu. Wyobraźmy sobie stadion piłkarski. Gdyby atom był wielkości tego stadionu, jego jądro byłoby zaledwie ziarenkiem piasku na środku boiska! Mimo tak niewiarygodnie małych rozmiarów, to właśnie w tym "ziarenku" skupione jest ponad 99,9% całej masy atomu. Ta ogromna gęstość wynika z faktu, że protony i neutrony, które są relatywnie ciężkimi cząstkami, są upakowane w niezwykle ograniczonej przestrzeni. To właśnie ta koncentracja masy w tak małej objętości sprawia, że jądro atomowe jest prawdziwym mikrokosmosem o zdumiewającej gęstości.
Siły jądrowe: klej, który trzyma wszystko razem
Skoro protony są dodatnio naładowane, a ładunki jednoimienne się odpychają, to dlaczego jądro atomowe się nie rozpada? Odpowiedzią są silne oddziaływania jądrowe, często nazywane po prostu siłami jądrowymi. To one działają jak niezwykle potężny "klej", który utrzymuje protony i neutrony razem w jądrze. Są to siły znacznie silniejsze niż elektrostatyczne odpychanie między protonami, ale działają tylko na bardzo krótkich dystansach właśnie dlatego są tak skuteczne w maleńkim jądrze. Bez nich stabilne atomy, a tym samym cała materia, nie mogłyby istnieć.

Elektrony wokół jądra: powłoki i ich znaczenie
Wiedząc już, co dzieje się w jądrze, przenieśmy naszą uwagę na elektrony krążące wokół niego. Nie wyobrażajmy sobie ich jednak jako planet na sztywnych orbitach. Współczesna fizyka kwantowa mówi nam, że elektrony zajmują raczej obszary o różnym poziomie energii, które nazywamy powłokami elektronowymi. To właśnie te powłoki są kluczem do zrozumienia, jak atomy wchodzą ze sobą w interakcje i tworzą wiązania chemiczne.
Powłoki elektronowe: energetyczne "piętra" dla elektronów
Powłoki elektronowe to nic innego jak kolejne "piętra energetyczne" wokół jądra, na których elektrony mogą się znajdować. Oznaczamy je kolejnymi literami alfabetu, zaczynając od jądra: K, L, M, N i tak dalej. Każda taka powłoka ma określoną, maksymalną liczbę elektronów, którą może pomieścić. Tę pojemność określa prosty wzór: 2n², gdzie "n" to numer powłoki (dla K, n=1; dla L, n=2 itd.).
- Powłoka K (n=1): może pomieścić maksymalnie 2 * 1² = 2 elektrony.
- Powłoka L (n=2): może pomieścić maksymalnie 2 * 2² = 8 elektronów.
- Powłoka M (n=3): może pomieścić maksymalnie 2 * 3² = 18 elektronów.
Elektrony zawsze dążą do zajęcia powłok o najniższej energii, czyli tych najbliżej jądra. Dopiero po zapełnieniu niższych powłok, zaczynają obsadzać te wyższe.
Elektrony walencyjne: klucz do chemicznych reakcji
Spośród wszystkich elektronów w atomie, te znajdujące się na najbardziej zewnętrznej powłoce elektronowej są absolutnie najważniejsze z punktu widzenia chemii. Nazywamy je elektronami walencyjnymi. To właśnie one decydują o tym, jak atom będzie reagował z innymi atomami, czy będzie tworzył wiązania, oddawał elektrony, czy je przyjmował. Można powiedzieć, że elektrony walencyjne to "wizytówka" chemiczna każdego pierwiastka, określająca jego właściwości i zachowanie w reakcjach.
Jak poprawnie zapisać konfigurację elektronową? Poradnik krok po kroku
Konfiguracja elektronowa to po prostu sposób, w jaki elektrony są rozmieszczone na poszczególnych powłokach i podpowłokach atomu. Znajomość tej konfiguracji jest niezwykle istotna, ponieważ pozwala nam przewidzieć, jak dany pierwiastek będzie się zachowywał w reakcjach chemicznych. To właśnie na podstawie konfiguracji elektronowej, a zwłaszcza liczby elektronów walencyjnych, jesteśmy w stanie zrozumieć, dlaczego sód tak chętnie oddaje elektron, a fluor tak łapczywie go przyjmuje. Chociaż nie będziemy tutaj wchodzić w szczegółowe zasady zapisu, pamiętajmy, że to właśnie ten rozkład elektronów jest podstawą całej chemii.
Liczby atomowe i masowe: klucze do tożsamości pierwiastka
Poza samymi cząstkami elementarnymi, istnieją dwie kluczowe liczby, które pozwalają nam jednoznacznie zidentyfikować każdy atom i zrozumieć jego podstawowe właściwości: liczba atomowa i liczba masowa. To one są niczym unikalne kody kreskowe dla każdego pierwiastka chemicznego.
Liczba atomowa (Z): dowód osobisty każdego pierwiastka
Jak już wspomniałem, liczba atomowa (Z) to po prostu liczba protonów w jądrze atomu. Jest to absolutnie fundamentalna wartość, która definiuje tożsamość pierwiastka. Każdy atom, który ma taką samą liczbę protonów, należy do tego samego pierwiastka. Na przykład, jeśli atom ma 6 protonów, zawsze jest to atom węgla. Nie ma dwóch pierwiastków o tej samej liczbie atomowej. To właśnie liczba Z porządkuje pierwiastki w układzie okresowym i jest ich najważniejszym identyfikatorem.
Liczba masowa (A): jak obliczyć całkowitą masę atomu?
Liczba masowa (A) to z kolei suma liczby protonów i neutronów w jądrze atomu. Możemy ją wyrazić prostym wzorem: A = Z + N, gdzie N to liczba neutronów. Liczba masowa jest kluczowa dla określenia przybliżonej masy atomu, ponieważ to protony i neutrony w jądrze stanowią zdecydowaną większość jego masy. Elektrony, ze względu na swoją znikomą masę, są zazwyczaj pomijane przy obliczaniu liczby masowej. Dzięki niej wiemy, jak "ciężki" jest dany izotop pierwiastka.
Czym są izotopy i dlaczego mają znaczenie?
Pojęcie izotopów jest niezwykle ważne. Izotopy to atomy tego samego pierwiastka, co oznacza, że mają taką samą liczbę protonów (tę samą liczbę atomową Z). Różnią się jednak liczbą neutronów w jądrze. W konsekwencji mają różną liczbę masową (A). Na przykład, węgiel-12 ma 6 protonów i 6 neutronów, podczas gdy węgiel-14 ma 6 protonów i 8 neutronów. Mimo różnic w masie, izotopy danego pierwiastka wykazują niemal identyczne właściwości chemiczne, ponieważ to elektrony walencyjne (których liczba jest taka sama) decydują o chemii. Izotopy znajdują szerokie zastosowanie, od medycyny (diagnostyka, leczenie) po datowanie archeologiczne.
Przeczytaj również: Ile atomów wodoru w 5 molach NH₃? Oblicz krok po kroku!
Ewolucja modelu atomu: od pomysłu do współczesności
Nasze rozumienie atomu nie pojawiło się z dnia na dzień. To fascynująca historia naukowych odkryć, błędów i przełomów. Na przestrzeni wieków, wraz z rozwojem eksperymentów i teorii, model atomu ewoluował, stając się coraz bardziej precyzyjny i złożony. Przyjrzyjmy się kilku kluczowym etapom tej podróży.
Model Rutherforda: rewolucyjne odkrycie jądra
Na początku XX wieku Ernest Rutherford przeprowadził słynny eksperyment z rozpraszaniem cząstek alfa na złotej folii. Wyniki były zaskakujące i obaliły dotychczasowy model atomu. Rutherford stwierdził, że atom musi mieć bardzo małe, gęste i dodatnio naładowane jądro, wokół którego krążą elektrony. Zaproponował tzw. planetarny model atomu, w którym elektrony orbitowały wokół jądra niczym planety wokół słońca. To było rewolucyjne odkrycie, które na zawsze zmieniło nasze postrzeganie atomu.
Model Bohra: dlaczego elektrony nie spadają na jądro?
Model Rutherforda miał jednak pewną wadę: zgodnie z klasyczną fizyką, krążące elektrony powinny tracić energię i w końcu spaść na jądro, co doprowadziłoby do niestabilności atomu. Niels Bohr, opierając się na koncepcjach kwantowych, rozwiązał ten problem. Wprowadził on ideę, że elektrony mogą krążyć wokół jądra tylko po ściśle określonych orbitach, na których nie emitują ani nie pochłaniają energii. Każda orbita odpowiadała innemu, skwantowanemu poziomowi energii. Elektrony mogły przeskakiwać między tymi orbitami, emitując lub absorbując energię w postaci kwantów światła.
Współczesny model kwantowy: gdzie tak naprawdę jest elektron?
Mimo sukcesów modelu Bohra, okazał się on niewystarczający dla bardziej złożonych atomów. Współczesny model atomu, czyli kwantowo-mechaniczny model, jest znacznie bardziej zaawansowany. Zgodnie z nim, nie możemy już mówić o elektronach krążących po stałych orbitach. Zamiast tego, elektrony są opisywane jako chmury prawdopodobieństwa. Oznacza to, że możemy jedynie określić obszar wokół jądra (tzw. orbital), w którym istnieje największe prawdopodobieństwo znalezienia danego elektronu. Ten model, choć bardziej abstrakcyjny, najlepiej oddaje falowo-cząsteczkową naturę elektronów i pozwala na niezwykle precyzyjne przewidywanie właściwości atomów.