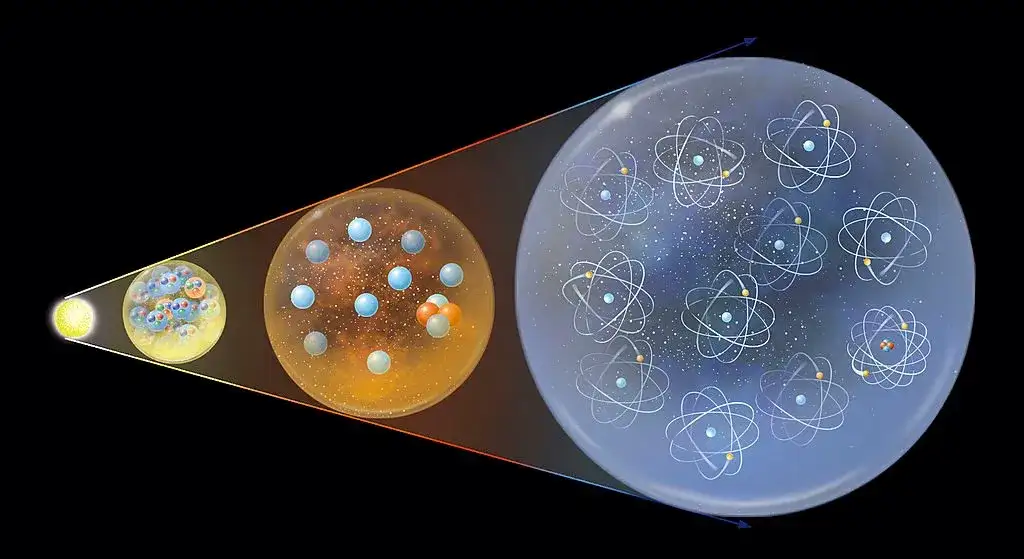
Zastanawialiście się kiedyś, co tak naprawdę tworzy wszystko wokół nas od najdrobniejszego ziarenka piasku, przez powietrze, którym oddychamy, aż po odległe gwiazdy? Odpowiedź kryje się w niezwykle małej, ale fundamentalnej cząstce: atomie. Zrozumienie jego budowy i właściwości to klucz do pojmowania materii i całego wszechświata.
Atom fundamentalny budulec materii i klucz do zrozumienia wszechświata
- Atom to podstawowy składnik materii, który zachowuje właściwości chemiczne danego pierwiastka.
- Składa się z dodatnio naładowanego jądra (zawierającego protony i neutrony) oraz otaczającej go chmury ujemnie naładowanych elektronów.
- Liczba protonów w jądrze (liczba atomowa Z) jednoznacznie definiuje rodzaj pierwiastka chemicznego.
- Elektrony walencyjne, znajdujące się na najbardziej zewnętrznej powłoce, odpowiadają za tworzenie wiązań chemicznych.
- Nasze rozumienie atomu ewoluowało od starożytnych koncepcji niepodzielnej cząstki do współczesnego, złożonego modelu kwantowo-mechanicznego.
- Wiedza o atomach ma kluczowe znaczenie dla rozwoju energii jądrowej, medycyny, datowania radiowęglowego i nanotechnologii.
Atom fundamentalny budulec wszechświata
Słowo „atom” wywodzi się z greckiego „átomos”, co dosłownie oznacza „niepodzielny”. Przez wieki ta nazwa idealnie oddawała ówczesne wyobrażenia o tej cząstce uważano, że jest to najmniejszy, niepodzielny element materii. Dziś wiemy, że choć atom jest niezwykle mały, to wcale nie jest niepodzielny i ma złożoną strukturę wewnętrzną. Mimo to, pozostaje on podstawowym składnikiem materii, który zachowuje wszystkie właściwości chemiczne danego pierwiastka. To właśnie atomy, łącząc się ze sobą, tworzą cząsteczki, a w konsekwencji całą otaczającą nas rzeczywistość.
Od filozoficznej idei do naukowej definicji: co dziś wiemy o atomie?
Historia atomu to fascynująca podróż od starożytnych spekulacji filozoficznych do precyzyjnych modeli naukowych. Już Demokryt z Abdery w V wieku p.n.e. postulował istnienie niewidzialnych, niepodzielnych cząstek, które nazwał atomami. Przez kolejne stulecia idea ta pozostawała w sferze filozofii, aż do XIX wieku, kiedy to John Dalton sformułował pierwszą naukową teorię atomistyczną. Od tamtej pory, dzięki pracy wielu wybitnych naukowców, nasze rozumienie atomu ewoluowało od prostej, twardej kulki do skomplikowanego systemu kwantowo-mechanicznego, który wciąż jest przedmiotem badań.
Dlaczego atomy są tak małe, a jednocześnie tak ważne?
Atomy są niewyobrażalnie małe ich rozmiary mierzy się w pikometrach (bilionowych częściach metra). Gdybyśmy chcieli ułożyć atomy w linii, aby pokonać szerokość ludzkiego włosa, potrzebowalibyśmy ich setek tysięcy! Mimo tych mikroskopijnych rozmiarów, ich znaczenie jest kolosalne. To właśnie atomy są fundamentem całego wszechświata. Ich unikalne właściwości i sposób, w jaki oddziałują ze sobą, definiują chemię i fizykę materii. Bez zrozumienia atomów nie bylibyśmy w stanie wyjaśnić, dlaczego woda jest cieczą, dlaczego metale przewodzą prąd, ani jak działają reakcje chemiczne, które podtrzymują życie.
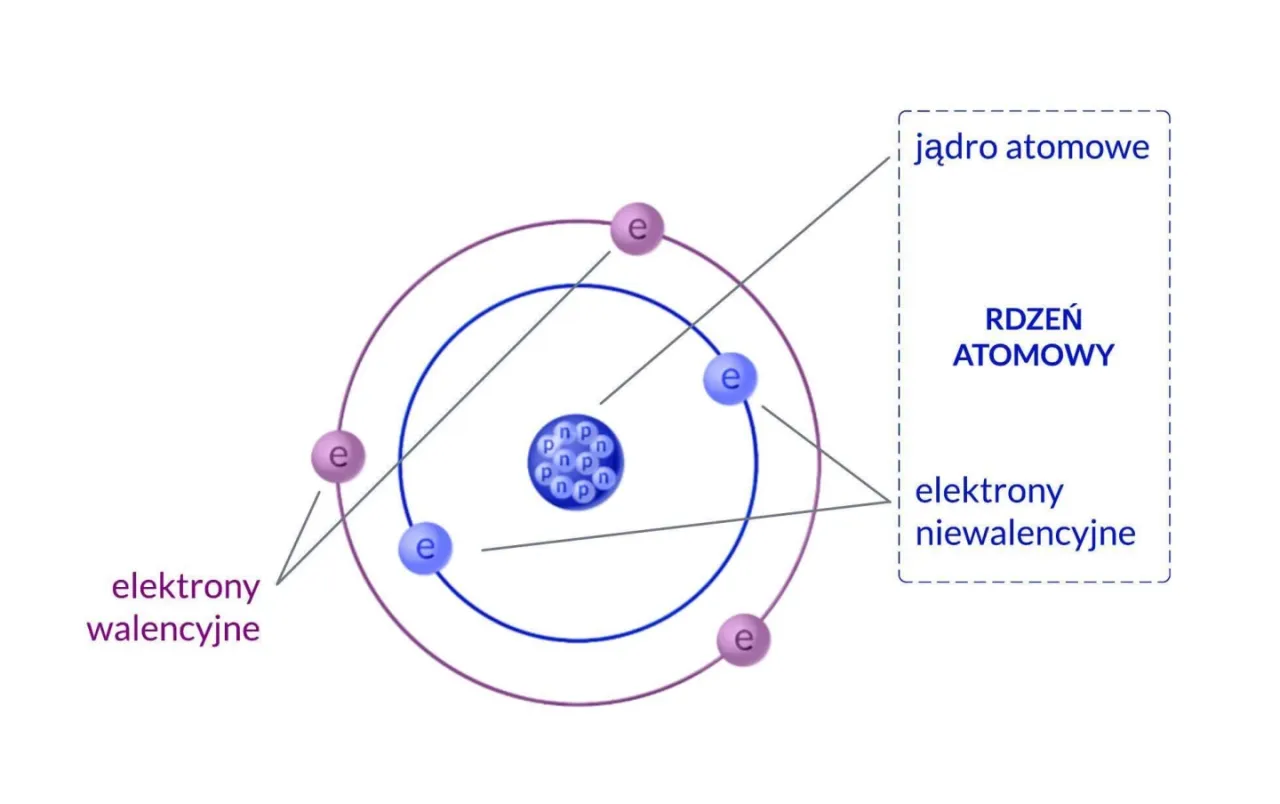
Zaglądamy do środka: budowa atomu
Kiedy mówimy o budowie atomu, musimy wyobrazić sobie dwie główne części: gęste, dodatnio naładowane jądro atomowe oraz otaczającą je rozległą, ujemnie naładowaną chmurę elektronową. To właśnie wzajemne oddziaływanie tych komponentów nadaje atomowi jego charakterystyczne właściwości.Jądro atomowe: gęste i masywne centrum dowodzenia
Jądro atomowe to prawdziwe centrum atomu choć zajmuje zaledwie ułamek jego objętości, skupia w sobie ponad 99,9% całej masy atomu. Jest niezwykle gęste, a jego składniki, zwane nukleonami, są ze sobą silnie związane. Nukleony dzielą się na dwa typy: protony i neutrony. To właśnie ich liczba i wzajemne proporcje decydują o stabilności i tożsamości chemicznej atomu.
Protony, czyli dodatni ładunek definiujący pierwiastek
Protony to cząstki subatomowe o dodatnim ładunku elektrycznym. Każdy proton ma ładunek równy elementarnemu ładunkowi dodatniemu. Co najważniejsze, to właśnie liczba protonów w jądrze atomowym, nazywana liczbą atomową (Z), jednoznacznie definiuje, z jakim pierwiastkiem chemicznym mamy do czynienia. Na przykład, każdy atom wodoru ma jeden proton, każdy atom helu ma dwa protony, a każdy atom węgla sześć. To jak "dowód osobisty" dla każdego pierwiastka.
Neutrony: ciche strażnicy stabilności jądra
Neutrony to cząstki subatomowe, które, jak sama nazwa wskazuje, są elektrycznie obojętne nie posiadają ładunku elektrycznego. Ich masa jest bardzo zbliżona do masy protonów. Rola neutronów jest kluczowa dla stabilności jądra. Protony, posiadając ten sam ładunek dodatni, naturalnie odpychałyby się nawzajem. Neutrony działają jak "klej", wiążąc protony razem poprzez silne oddziaływania jądrowe, zapobiegając rozpadowi jądra. Bez nich większość pierwiastków byłaby niestabilna.
Tajemnicza chmura elektronowa: gdzie krążą elektrony?
Wokół gęstego jądra atomowego rozciąga się znacznie większa, ale znacznie mniej masywna chmura elektronowa. To obszar, w którym z największym prawdopodobieństwem można znaleźć elektrony. Elektrony to cząstki o ujemnym ładunku elektrycznym i masie ponad 1800 razy mniejszej niż protony czy neutrony. W obojętnym elektrycznie atomie liczba elektronów jest zawsze równa liczbie protonów, co zapewnia równowagę ładunków. Elektrony nie krążą swobodnie są rozmieszczone na określonych poziomach energetycznych, zwanych powłokami elektronowymi, które decydują o chemicznych właściwościach atomu.
Kluczowe pojęcia: jak opisać i zrozumieć każdy atom?
Aby w pełni zrozumieć świat atomów i chemii, musimy posługiwać się kilkoma podstawowymi pojęciami. To one pozwalają nam precyzyjnie opisać każdy atom i przewidzieć jego zachowanie w różnych warunkach.
Liczba atomowa (Z) dowód osobisty każdego pierwiastka
Jak już wspomniałem, liczba atomowa (Z) to nic innego jak liczba protonów w jądrze atomowym. Jest to absolutnie fundamentalna wartość, ponieważ to właśnie ona definiuje, z jakim pierwiastkiem chemicznym mamy do czynienia. Każdy pierwiastek ma swoją unikalną liczbę atomową, którą znajdziemy w układzie okresowym pierwiastków. To tak, jakby liczba atomowa była "dowodem osobistym" każdego atomu, niezmiennym i jednoznacznym.Liczba masowa (A) czyli ile waży atom?
Liczba masowa (A) to suma wszystkich nukleonów, czyli protonów i neutronów, znajdujących się w jądrze atomowym. Ponieważ elektrony mają znikomą masę w porównaniu do nukleonów, liczba masowa daje nam bardzo dobre przybliżenie masy atomu. Jest to kluczowe pojęcie, zwłaszcza gdy mówimy o izotopach, ponieważ to właśnie różnice w liczbie neutronów wpływają na liczbę masową.
Izotopy: te same pierwiastki, ale w różnych wersjach
Pojęcie izotopów jest niezwykle ważne. Izotopy to odmiany atomów tego samego pierwiastka, które mają taką samą liczbę protonów (Z), ale różną liczbę neutronów. W konsekwencji mają różną liczbę masową (A), a co za tym idzie różną masę. Klasycznym przykładem są izotopy wodoru:
- Prot (1H) ma 1 proton i 0 neutronów.
- Deuter (2H) ma 1 proton i 1 neutron.
- Tryt (3H) ma 1 proton i 2 neutrony.
Czym są jony i dlaczego atom nie zawsze jest obojętny?
Wspomniałem wcześniej, że w obojętnym atomie liczba elektronów jest równa liczbie protonów. Jednak atomy mogą tracić lub zyskiwać elektrony. Kiedy tak się dzieje, atom przestaje być elektrycznie obojętny i staje się jonem. Jeśli atom straci elektron (lub elektrony), będzie miał więcej protonów niż elektronów i stanie się kationem (jonem dodatnim). Jeśli zyska elektron (lub elektrony), będzie miał więcej elektronów niż protonów i stanie się anionem (jonem ujemnym). Za te procesy odpowiadają przede wszystkim elektrony walencyjne, czyli te znajdujące się na najbardziej zewnętrznej powłoce, które odgrywają kluczową rolę w tworzeniu wiązań chemicznych i reakcjach.
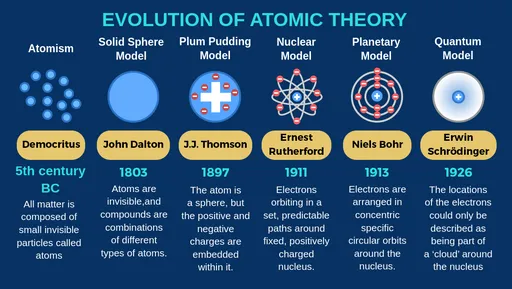
Krótka podróż przez historię: jak zmieniało się nasze wyobrażenie o atomie?
Nasze rozumienie atomu nie pojawiło się z dnia na dzień. To wynik wieków obserwacji, eksperymentów i teorii, które stopniowo odsłaniały coraz to nowe aspekty tej fundamentalnej cząstki. Przyjrzyjmy się najważniejszym etapom tej fascynującej podróży.
Od niepodzielnej kulki Daltona do "ciasta z rodzynkami" Thomsona
W początkach XIX wieku John Dalton przedstawił swoją teorię atomistyczną, w której atomy były opisywane jako twarde, niepodzielne kule, różniące się masą i rozmiarami dla różnych pierwiastków. Była to rewolucyjna koncepcja, która położyła podwaliny pod współczesną chemię. Jednak pod koniec tego samego wieku, w 1897 roku, J.J. Thomson odkrył elektron. To odkrycie zmusiło naukowców do rewizji modelu Daltona. Thomson zaproponował model atomu, często nazywany modelem "ciasta z rodzynkami", w którym ujemnie naładowane elektrony były zanurzone w jednorodnej, dodatnio naładowanej masie, niczym rodzynki w cieście.
Rewolucja Rutherforda: odkrycie małego, gęstego jądra
Prawdziwa rewolucja nastąpiła w 1911 roku, dzięki Ernestowi Rutherfordowi i jego słynnemu eksperymentowi ze złotą folią. Rutherford bombardował cienką złotą folię cząstkami alfa i zaobserwował, że większość z nich przechodziła przez folię bez przeszkód, ale niewielka część była silnie odchylana, a nawet odbijała się. To doprowadziło go do wniosku, że atom nie jest jednorodną kulą, lecz posiada małe, gęste, dodatnio naładowane jądro, wokół którego krążą elektrony. Zaproponował "planetarny" model atomu, w którym elektrony orbitują wokół jądra, podobnie jak planety wokół Słońca.
Model planetarny Bohra: elektrony na swoich orbitach
Model Rutherforda miał jednak pewne niedociągnięcia zgodnie z klasyczną fizyką elektrony krążące wokół jądra powinny tracić energię i w końcu spaść na jądro. Aby rozwiązać ten problem, w 1913 roku Niels Bohr udoskonalił model, wprowadzając pojęcie orbit stacjonarnych. Według Bohra, elektrony mogą krążyć tylko po ściśle określonych orbitach, na których nie emitują ani nie absorbują energii. Dopiero przeskakując między tymi orbitami, elektron może pochłonąć lub wyemitować kwant energii. Model Bohra z powodzeniem wyjaśnił widma emisyjne wodoru.
Współczesny model kwantowy: od pewności do prawdopodobieństwa
Mimo sukcesów modelu Bohra, okazał się on niewystarczający dla bardziej złożonych atomów. Na początku XX wieku rozwój mechaniki kwantowej przyniósł zupełnie nowe spojrzenie na atom. Współczesny, kwantowo-mechaniczny model atomu porzuca ideę ściśle określonych orbit na rzecz orbitali obszarów w przestrzeni, w których istnieje największe prawdopodobieństwo znalezienia elektronu. To model oparty na prawdopodobieństwie, a nie na pewności. Co więcej, wiemy dziś, że nawet protony i neutrony nie są cząstkami elementarnymi, lecz składają się z jeszcze mniejszych cząstek, zwanych kwarkami. To pokazuje, jak daleko zaszła nasza wiedza i jak złożony jest świat w skali mikro.
Wiedza o atomach zmienia nasz świat: praktyczne zastosowania
Zrozumienie budowy i zachowania atomów nie jest tylko domeną teoretycznej fizyki. To wiedza, która dosłownie zmieniła nasz świat, otwierając drzwi do niezliczonych innowacji i technologii, które dziś uważamy za oczywiste. Pozwólcie, że przedstawię kilka kluczowych przykładów.
Wiązania chemiczne: jak atomy łączą się, tworząc cząsteczki i materię?
Podstawą całej chemii jest zdolność atomów do łączenia się ze sobą, tworząc cząsteczki. To właśnie elektrony walencyjne, czyli te najbardziej zewnętrzne, odgrywają tu kluczową rolę. Poprzez ich uwspólnianie (wiązania kowalencyjne) lub przenoszenie (wiązania jonowe), atomy tworzą stabilne układy. Zrozumienie mechanizmów wiązań chemicznych pozwoliło nam nie tylko wyjaśnić, jak powstają wszystkie substancje wokół nas, ale także projektować nowe materiały o pożądanych właściwościach od tworzyw sztucznych, przez leki, aż po zaawansowane stopy metali. To fundament inżynierii materiałowej i farmacji.
Energia jądrowa: kontrolowana moc ukryta w jądrze
Jednym z najbardziej spektakularnych zastosowań wiedzy o atomach jest energia jądrowa. Odkrycie, że jądra ciężkich atomów, takich jak uran, mogą ulegać rozszczepieniu, uwalniając przy tym ogromne ilości energii, otworzyło drogę do budowy elektrowni jądrowych. Dzięki kontrolowanym reakcjom rozszczepienia możemy produkować energię elektryczną na dużą skalę, z minimalną emisją gazów cieplarnianych. To potężne źródło energii, które wymaga jednak precyzyjnego zrozumienia i kontroli procesów jądrowych.
Medycyna i diagnostyka: jak izotopy ratują życie?
Izotopy promieniotwórcze, czyli atomy tego samego pierwiastka o różnej liczbie neutronów, znalazły szerokie zastosowanie w medycynie. W diagnostyce są wykorzystywane jako znaczniki w badaniach takich jak scyntygrafia czy pozytonowa tomografia emisyjna (PET), pozwalając na wczesne wykrywanie chorób, w tym nowotworów. W terapii, zwłaszcza w radioterapii, promieniowanie emitowane przez izotopy jest precyzyjnie kierowane na komórki nowotworowe, niszcząc je i ratując życie pacjentów. To dziedzina, w której fizyka atomowa bezpośrednio przekłada się na poprawę zdrowia publicznego.
Od datowania zabytków po nanotechnologię: praktyczne zastosowania atomu
- Datowanie radiowęglowe: Dzięki izotopowi węgla 14C możemy precyzyjnie określać wiek znalezisk organicznych, takich jak starożytne artefakty czy szczątki prehistorycznych zwierząt. To narzędzie nieocenione dla archeologii i paleontologii.
- Zastosowania w technice i przemyśle: Radioizotopy są wykorzystywane w czujnikach dymu, do kontroli jakości materiałów (np. grubości blach), w sterylizacji sprzętu medycznego czy żywności, a także w wielu procesach przemysłowych, gdzie wymagana jest precyzyjna kontrola i pomiary.
- Nanotechnologia: To dziedzina, która zajmuje się manipulowaniem materią na poziomie pojedynczych atomów i cząsteczek. Dzięki niej możemy tworzyć zupełnie nowe materiały o unikalnych właściwościach, projektować miniaturowe urządzenia czy rozwijać nowe metody dostarczania leków. Zrozumienie atomu jest tu absolutnie kluczowe.
Przeczytaj również: Jak uczyć się chemii? Skuteczne metody i matura bez stresu!
Czy atom to koniec podziału? Cząstki elementarne
Choć przez długi czas atom był uważany za niepodzielny, a potem za podstawowy budulec materii, współczesna fizyka poszła jeszcze dalej. Okazuje się, że nawet składniki atomu protony i neutrony nie są ostatnim etapem podziału materii. To prowadzi nas do fascynującego świata cząstek elementarnych.
Kwarki: fundamentalne składniki protonów i neutronów
Dziś wiemy, że protony i neutrony, które tworzą jądro atomowe, nie są cząstkami elementarnymi. Składają się one z jeszcze mniejszych, fundamentalnych cząstek, zwanych kwarkami. Istnieje sześć rodzajów kwarków (góra, dół, dziwny, powabny, piękny, prawdziwy), a protony i neutrony są zbudowane z trzech kwarków każdy. Na przykład, proton składa się z dwóch kwarków "góra" i jednego kwarka "dół", natomiast neutron z jednego kwarka "góra" i dwóch kwarków "dół". To pokazuje, jak niezwykle złożona jest struktura materii na najniższych poziomach.
Atom jako brama do zrozumienia fundamentalnych praw fizyki
Wszystko to prowadzi do wniosku, że atom, choć pozornie prosty w swojej koncepcji, jest w rzeczywistości niezwykle złożonym i fascynującym obiektem. Jego badanie i zrozumienie nie tylko pozwoliło nam na rozwój chemii i technologii, ale także stało się bramą do zgłębiania fundamentalnych praw fizyki, które rządzą wszechświatem. Od najmniejszych kwarków po największe galaktyki wszystko jest ze sobą powiązane, a atom jest kluczem do rozwikłania wielu kosmicznych tajemnic.