Cześć! Jeśli szukasz prostego i kreatywnego sposobu na stworzenie modelu atomu na lekcję chemii, to trafiłeś idealnie. W tym artykule przeprowadzę Cię krok po kroku przez cały proces, pokazując, jak zrozumieć podstawy budowy atomu i wykonać zadanie w prosty i angażujący sposób, nawet jeśli chemia wydaje Ci się skomplikowana.
Prosty model atomu na chemię? Oto co musisz wiedzieć, by zrobić go bez problemu
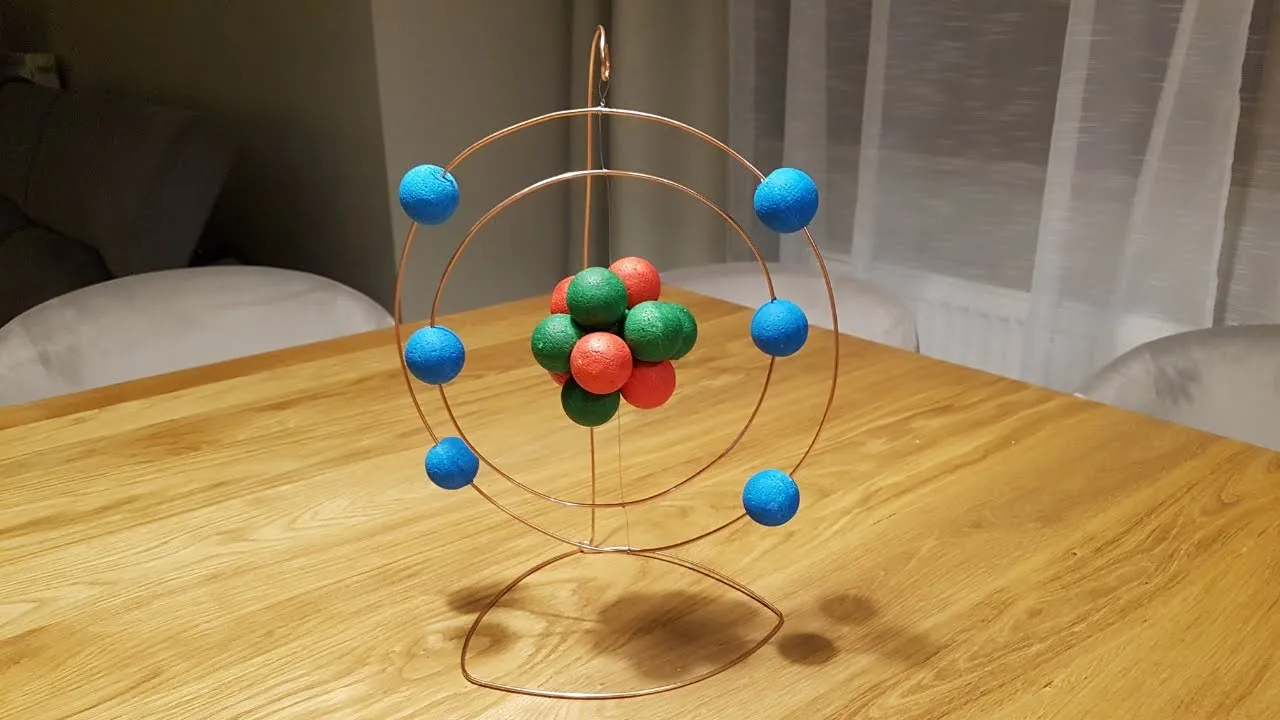
- Model atomu na chemię najłatwiej wykonać, bazując na planetarnym modelu Bohra, który jest idealny do szkolnych projektów.
- Do budowy wykorzystaj łatwo dostępne materiały, takie jak plastelina, kulki styropianowe, druty kreatywne, koraliki czy nawet żelki.
- Kluczem do sukcesu jest prawidłowe odczytanie z układu okresowego liczby protonów, neutronów i elektronów dla wybranego pierwiastka.
- Konstrukcja modelu obejmuje stworzenie jądra (protony i neutrony), uformowanie orbit elektronowych oraz rozmieszczenie na nich elektronów.
- Wybierz proste pierwiastki (np. Hel, Lit, Węgiel), aby model był czytelny, a jego budowa nie sprawiła trudności.
- Zadbaj o stabilność konstrukcji, używając solidnej podstawy i mocnych łączeń, aby model nie rozpadł się podczas prezentacji.
Zanim zaczniesz: szybka ściągawka z budowy atomu
Zanim zabierzesz się za tworzenie swojego atomu, musisz zrozumieć jego podstawową budowę. Nie martw się, to wcale nie jest takie trudne! Atom to nic innego jak maleńka cząstka, która składa się z dwóch głównych części: dodatnio naładowanego jądra atomowego i krążących wokół niego ujemnie naładowanych elektronów. Zrozumienie tych fundamentów jest absolutnie kluczowe, aby Twój model był poprawny i zrobił wrażenie na nauczycielu.
Czym jest jądro atomowe? Klucz do tożsamości pierwiastka
Wyobraź sobie jądro atomowe jako serce atomu to centralna część, która skupia w sobie niemal całą jego masę. Jest ono zbudowane z dwóch rodzajów cząstek: protonów i neutronów. Co ważne, to właśnie liczba protonów w jądrze decyduje o tym, jaki to pierwiastek. Każdy pierwiastek ma swoją unikalną liczbę protonów, która jest jego "dowodem osobistym".Protony i neutrony: dwa składniki serca atomu
W jądrze atomowym znajdziesz dwa typy cząstek. Protony to cząstki z ładunkiem dodatnim to one nadają jądru jego pozytywny charakter. Z kolei neutrony to cząstki obojętne elektrycznie, czyli nie mają żadnego ładunku. Ich obecność w jądrze wpływa głównie na masę atomu, ale nie zmienia jego tożsamości chemicznej. Razem tworzą stabilne centrum, wokół którego wszystko się kręci.
Elektrony na orbitach: o co chodzi z tymi powłokami?
Poza jądrem atomowym, w atomie krążą elektrony maleńkie cząstki z ładunkiem ujemnym. Nie latają one chaotycznie, ale poruszają się po określonych "ścieżkach", które nazywamy powłokami elektronowymi. W obojętnym atomie, czyli takim, który nie jest naładowany, liczba elektronów jest zawsze równa liczbie protonów. Co więcej, każda powłoka ma swoją "pojemność" na przykład pierwsza powłoka może pomieścić maksymalnie 2 elektrony, a druga aż 8. To ważne przy rozmieszczaniu ich w Twoim modelu!Dlaczego model Bohra to najlepszy wybór do szkolnego projektu?
W świecie nauki istnieją różne modele atomu, ale do szkolnych projektów najczęściej i najchętniej wykorzystujemy planetarny model Bohra. Dlaczego? Bo jest po prostu najłatwiejszy do zrozumienia i wizualnie bardzo czytelny! W tym modelu elektrony krążą wokół jądra po stałych, kołowych orbitach, niczym planety wokół słońca. Dzięki temu łatwo jest przedstawić poszczególne powłoki i rozmieszczenie elektronów, co czyni go idealnym wyborem do Twojego zadania.
Przygotuj swój warsztat: z czego najłatwiej i najtaniej zrobić model atomu
Nie musisz wydawać fortuny, żeby stworzyć świetny model atomu! Wiele potrzebnych materiałów masz prawdopodobnie już w domu, a resztę bez problemu znajdziesz w sklepie papierniczym za grosze. Kluczem jest kreatywność i wykorzystanie tego, co jest pod ręką. Zobacz, co możesz wykorzystać!
Domowe skarby: plastelina, kulki styropianowe i druciki
- Na jądro (protony i neutrony): Idealnie sprawdzi się plastelina w dwóch różnych kolorach jeden kolor dla protonów, drugi dla neutronów. Możesz też użyć kulek styropianowych, większych koralików, pomponów, a nawet małych kulek z papieru.
- Na orbity (powłoki elektronowe): Świetnie nadają się druty kreatywne (tzw. chenille sticks), które łatwo wyginać w okręgi. Możesz też wykorzystać patyczki do szaszłyków, słomki do napojów, a nawet obręcze z plastikowych butelek.
- Na elektrony: Tutaj sprawdzą się mniejsze kulki plasteliny, koraliki, guziki, ziarna grochu, małe pompony czy nawet kawałki makaronu. Ważne, żeby były małe i łatwe do przymocowania.
Słodka chemia: jak zbudować jadalny model z żelków i wykałaczek?
Kto powiedział, że nauka nie może być smaczna? Jeśli chcesz zrobić model, który po prezentacji będzie można zjeść, postaw na żelki w różnych kolorach! Wykorzystaj jeden kolor na protony, drugi na neutrony, a trzeci na elektrony. Do połączeń użyj wykałaczek. To super kreatywny i zabawny sposób na naukę, który z pewnością zaskoczy Twojego nauczyciela!
Recykling w służbie nauki: wykorzystaj nakrętki, słomki i tekturę
Pamiętaj o ekologii! Możesz stworzyć fantastyczny model atomu, wykorzystując materiały z recyklingu. Plastikowe nakrętki świetnie sprawdzą się jako elektrony, słomki mogą posłużyć do uformowania orbit, a kawałek tektury z kartonu będzie idealną podstawą lub bazą do płaskiego modelu. To dowód, że nauka i troska o środowisko mogą iść w parze.
Lista zakupów dla ambitnych: co warto kupić w sklepie papierniczym?
Jeśli Twoje domowe zasoby są nieco ograniczone, oto kilka rzeczy, które warto dokupić w sklepie papierniczym lub plastycznym:
- Kolorowe druty florystyczne lub kreatywne są elastyczne i łatwo z nich formować orbity.
- Zestaw kulek styropianowych o różnych rozmiarach idealne na jądro i elektrony.
- Klej na gorąco (z pistoletem) zapewni trwałe i szybkie łączenie elementów.
- Małe koraliki lub pompony doskonałe na elektrony.
Instrukcja krok po kroku: zbuduj model atomu, który zachwyci nauczyciela
Teraz, kiedy masz już wszystkie materiały i znasz podstawy, czas przejść do działania! Poniżej znajdziesz szczegółową instrukcję, która krok po kroku poprowadzi Cię przez proces tworzenia modelu atomu. Zapewniam, że każdy etap jest prosty do wykonania, a efekt końcowy z pewnością zrobi wrażenie.
-
Krok 1: wybierz swój pierwiastek (nasze rekomendacje dla początkujących)
Pierwszym i najważniejszym krokiem jest wybranie pierwiastka, którego model chcesz stworzyć. Dla początkujących zdecydowanie polecam proste pierwiastki z początku układu okresowego, takie jak Hel (He), Lit (Li), Beryl (Be), Węgiel (C) lub Tlen (O). Mają one niewielką liczbę cząstek, co sprawi, że Twój model będzie czytelny i łatwy do wykonania.
-
Krok 2: policz cząstki jak odczytać informacje z układu okresowego?
Teraz musisz stać się detektywem i odczytać ważne informacje z układu okresowego! Znajdź swój wybrany pierwiastek. Liczba atomowa (Z), która zazwyczaj znajduje się w lewym dolnym rogu symbolu pierwiastka, powie Ci, ile ma on protonów. Pamiętaj, że w obojętnym atomie liczba elektronów jest zawsze równa liczbie protonów. Z kolei liczba masowa (A) to suma protonów i neutronów. Aby obliczyć liczbę neutronów, po prostu odejmij liczbę atomową od liczby masowej (A - Z = liczba neutronów). Zapisz te liczby będą Ci potrzebne!
-
Krok 3: stwórz jądro atomowe centrum Twojego modelu
Czas na serce Twojego atomu! Weź dwa różne kolory plasteliny (lub inne wybrane materiały). Z jednego koloru uformuj kulki reprezentujące protony (w liczbie, którą obliczyłeś). Z drugiego koloru uformuj kulki reprezentujące neutrony. Następnie połącz te kulki ciasno ze sobą, tworząc zwarte jądro atomowe. Upewnij się, że jest ono stabilne i wyraźnie widać dwa kolory.
-
Krok 4: uformuj orbity elektronowe szkielet konstrukcji
Teraz zajmij się powłokami elektronowymi. Z drutu kreatywnego lub słomek uformuj okręgi. Pamiętaj, że każda powłoka powinna być osobnym okręgiem, a odległości między nimi powinny być widoczne. Przymocuj te okręgi do jądra (jeśli jest to model wiszący) lub do solidnej podstawy (np. kawałka styropianu), tak aby tworzyły koncentryczne kręgi wokół jądra. Możesz użyć kleju na gorąco, aby zapewnić stabilność.
-
Krok 5: rozmieść elektrony na powłokach klucz do stabilności
Ostatni, ale bardzo ważny krok! Teraz musisz rozmieścić elektrony na powłokach. Pamiętaj o pojemności powłok: na pierwszej powłoce zmieszczą się maksymalnie 2 elektrony, na drugiej 8, na trzeciej 18 itd. Użyj małych kulek plasteliny, koralików lub innych wybranych materiałów jako elektronów. Umieść je na odpowiednich orbitach, zgodnie z konfiguracją elektronową Twojego pierwiastka. Upewnij się, że są dobrze przymocowane, aby nie odpadły podczas prezentacji.

Potrzebujesz inspiracji? 5 kreatywnych pomysłów na niebanalny model atomu
Jeśli chcesz, aby Twój model atomu wyróżniał się spośród innych i naprawdę zachwycił nauczyciela, mam dla Ciebie kilka kreatywnych pomysłów. Czasami warto pójść o krok dalej i dodać coś ekstra!
Pomysł 1: wiszący model mobilny nauka, która krąży nad głową
Zamiast tradycyjnego modelu na podstawce, stwórz model w formie mobilu. Jądro i orbity z elektronami możesz zawiesić na cienkich drucikach lub żyłce, tworząc dynamiczną i przestrzenną konstrukcję. Taki model pięknie prezentuje się w powietrzu i pokazuje ruch elektronów w bardzo efektowny sposób.
Pomysł 2: atom w słoiku efektowna makieta 3D
Chcesz, żeby Twój model był bezpieczny i efektowny? Zbuduj go wewnątrz przezroczystego słoika lub pudełka! To świetny sposób na stworzenie makiety 3D, która będzie chroniona przed uszkodzeniami i jednocześnie będzie wyglądać bardzo profesjonalnie. Możesz użyć żyłki, aby zawiesić elektrony w przestrzeni.
Pomysł 3: płaski model na tablicy korkowej przejrzysta i czytelna prezentacja
Jeśli preferujesz coś bardziej tradycyjnego, ale wciąż estetycznego, stwórz płaski model na tablicy korkowej lub kawałku tektury. Orbity możesz zaznaczyć sznurkiem lub markerem, a elektrony przymocować szpilkami. To bardzo czytelna i przejrzysta forma prezentacji, idealna do dokładnego omówienia budowy atomu.
Pomysł 4: model z oświetleniem LED dla fanów gadżetów
Dla bardziej zaawansowanych uczniów i fanów technologii mam propozycję: dodaj do swojego modelu małe diody LED! Możesz je umieścić w elektronach lub wzdłuż orbit, aby stworzyć podświetlany model, który z pewnością przyciągnie uwagę i zrobi ogromne wrażenie. To wymaga nieco więcej pracy, ale efekt jest spektakularny!
Pomysł 5: słodki i jadalny atom projekt, który można zjeść po ocenie
Wspominałem już o tym, ale warto podkreślić raz jeszcze jadalny model atomu to strzał w dziesiątkę! Wykorzystaj żelki, winogrona, pianki marshmallow i wykałaczki. Po udanej prezentacji możesz podzielić się swoim projektem z klasą lub po prostu zjeść go samemu. Nauka przez zabawę i smak to lubię!
Uniknij tych wpadek! Najczęstsze błędy przy budowie modelu
Chociaż tworzenie modelu atomu to świetna zabawa, łatwo jest popełnić kilka typowych błędów. Jako Daniel Kowalski, chcę Cię przed nimi ostrzec i podpowiedzieć, jak ich uniknąć, aby Twój projekt był bez zarzutu.
Pomyłka w obliczeniach: dlaczego podwójne sprawdzenie liczby cząstek jest kluczowe?
To chyba najczęstszy błąd! Łatwo jest pomylić się przy odczytywaniu liczby protonów, neutronów i elektronów z układu okresowego. Zawsze podwójnie sprawdź swoje obliczenia! Jedna mała pomyłka sprawi, że cały model będzie niepoprawny. Poświęć na to chwilę, a zaoszczędzisz sobie frustracji.
Niestabilna konstrukcja: jak zapewnić, by Twój model się nie rozpadł?
Nic gorszego niż model, który rozpada się w drodze do szkoły lub podczas prezentacji! Aby tego uniknąć, zadbaj o stabilność konstrukcji. Użyj solidnej podstawy (np. grubego kawałka styropianu lub drewna), a elementy łącz ze sobą mocnym klejem klej na gorąco jest tu niezastąpiony. Upewnij się, że orbity są sztywne i dobrze przymocowane.
Niewłaściwe proporcje i kolory: jak zadbać o czytelność projektu?
Pamiętaj, że w rzeczywistości jądro atomu jest niewyobrażalnie małe w porównaniu do całego atomu, ale w modelu szkolnym nie musisz dążyć do idealnych proporcji. Ważniejsze jest, aby wyraźnie rozróżnić protony i neutrony, używając różnych kolorów. Zadbaj też o to, by powłoki elektronowe były czytelnie oddzielone i żeby elektrony były dobrze widoczne. Przejrzystość to podstawa!
Przeczytaj również: Model atomu węgla: Zbuduj go sam! Prosta instrukcja DIY
Finał projektu: jak efektownie zaprezentować swój model atomu na lekcji
Twój model jest gotowy! Teraz czas na ostatni, ale równie ważny etap prezentację. Dobra prezentacja może sprawić, że Twój projekt zostanie oceniony jeszcze wyżej. Oto kilka wskazówek, jak zrobić wrażenie na nauczycielu i klasie.
-
Przygotuj krótką "instrukcję obsługi" swojego atomu
Nie tylko pokaż model, ale też o nim opowiedz! Przygotuj sobie krótką, ustną prezentację. Wymień wybrany pierwiastek, podaj liczbę jego protonów, neutronów i elektronów, a także wyjaśnij, jak zbudowałeś swój model i dlaczego wybrałeś takie, a nie inne materiały. To pokaże, że naprawdę rozumiesz temat.
-
Jak opowiedzieć o wybranym pierwiastku, by zaciekawić klasę?
Aby jeszcze bardziej zaciekawić słuchaczy, możesz dodać kilka ciekawostek związanych z wybranym pierwiastkiem. Gdzie występuje w naturze? Do czego jest używany w życiu codziennym? Czy ma jakieś niezwykłe właściwości? Taka dodatkowa wiedza zawsze robi dobre wrażenie i pokazuje Twoje zaangażowanie.

