Cześć! Daniel Kowalski z tej strony. Wiem, że budowa modelu atomu węgla na lekcję chemii może wydawać się skomplikowanym zadaniem, ale spokojnie to naprawdę proste! W rzeczywistości to fantastyczna okazja, żeby na własne oczy zobaczyć, jak zbudowana jest materia wokół nas. Z mojego doświadczenia wynika, że nauczyciele bardzo doceniają takie praktyczne projekty. W tym artykule przeprowadzę Cię przez każdy krok, od zebrania materiałów po finalne złożenie, tak aby Twój model był nie tylko poprawny merytorycznie, ale i robił wrażenie. Przygotuj się na chemiczną przygodę DIY!
Zbuduj model atomu węgla prosta instrukcja DIY na lekcję chemii
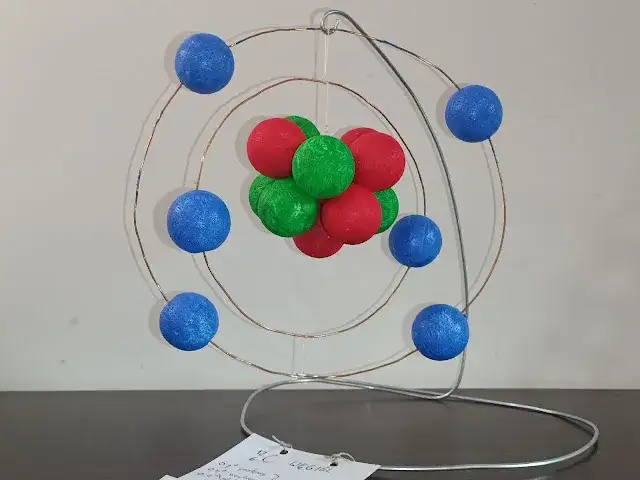
- Model atomu węgla-12 składa się z 6 protonów, 6 neutronów (w jądrze) i 6 elektronów (na powłokach).
- Elektrony rozmieszczone są na dwóch powłokach: 2 na pierwszej i 4 na drugiej (walencyjnej).
- Do budowy użyj łatwo dostępnych materiałów, takich jak plastelina, styropianowe kulki czy drut kreatywny.
- Pamiętaj o użyciu trzech różnych kolorów dla protonów, neutronów i elektronów.
- Kluczem do sukcesu jest dokładne przestrzeganie liczby cząstek i ich prawidłowe rozmieszczenie.
Atom węgla: Co musisz o nim wiedzieć, zanim zaczniesz budować?
Zanim zabierzemy się do pracy, musimy zrozumieć, co właściwie budujemy. Atom węgla, choć malutki, ma swoją precyzyjną strukturę, którą musimy odwzorować w naszym modelu. Nie martw się, to nie będzie skomplikowana lekcja fizyki kwantowej, a jedynie garść najważniejszych informacji, które pomogą Ci stworzyć poprawny i logiczny model.
Składniki Twojego modelu: Protony, neutrony i elektrony w pigułce
Każdy atom składa się z trzech podstawowych cząstek: protonów, neutronów i elektronów. Protony mają ładunek dodatni, neutrony są obojętne (nie mają ładunku), a elektrony mają ładunek ujemny. W przypadku atomu węgla, a dokładniej jego najpopularniejszego izotopu, węgla-¹², mamy do czynienia z bardzo konkretnymi liczbami: 6 protonów, 6 neutronów i 6 elektronów. Protony i neutrony tworzą zwarte jądro atomowe w samym centrum, natomiast elektrony krążą wokół tego jądra, niczym planety wokół słońca, choć w nieco bardziej skomplikowany sposób.
Dlaczego elektrony mieszkają na różnych "piętrach"? Proste wyjaśnienie powłok elektronowych
Elektrony nie krążą wokół jądra chaotycznie. Wyobraź sobie, że mają swoje "piętra" lub "tory", po których się poruszają nazywamy je powłokami elektronowymi. Każda powłoka może pomieścić określoną liczbę elektronów. W atomie węgla mamy dwie takie powłoki. Na tej najbliżej jądra, czyli pierwszej powłoce, mieszczą się tylko 2 elektrony. Pozostałe elektrony muszą zająć miejsce na kolejnej, drugiej powłoce. W przypadku węgla, na drugiej powłoce znajdziemy 4 elektrony. Ta zewnętrzna powłoka jest szczególnie ważna, bo to właśnie te elektrony (nazywane walencyjnymi) decydują o tym, jak atom węgla będzie się łączył z innymi atomami.
Węgiel-¹²: Dlaczego właśnie ten model budujemy na lekcje?
Możesz się zastanawiać, dlaczego mówimy o "węglu-¹²", skoro po prostu "węgiel" brzmi prościej. Otóż węgiel, podobnie jak wiele innych pierwiastków, występuje w naturze w różnych odmianach, czyli izotopach. Różnią się one liczbą neutronów w jądrze. Węgiel-¹² jest najpowszechniejszym izotopem węgla, stanowiącym około 98,9% całego węgla na Ziemi. Dlatego też, jeśli nauczyciel nie zaznaczy inaczej, to właśnie model węgla-¹² (czyli 6 protonów, 6 neutronów i 6 elektronów) jest tym, który zazwyczaj budujemy na lekcjach chemii. To standard, który każdy powinien znać.

Twój warsztat: Co będzie potrzebne do budowy modelu?
Z mojego doświadczenia wiem, że kluczem do udanego projektu DIY jest odpowiednie przygotowanie materiałów. Nie musisz wydawać fortuny na specjalistyczne artykuły wiele z nich znajdziesz w domu lub w pobliskim sklepie papierniczym. Pamiętaj, że liczy się kreatywność i wyraźne rozróżnienie poszczególnych elementów atomu.
Baza Twojego atomu: Co wybrać na protony, neutrony i elektrony?
Oto lista materiałów, które świetnie sprawdzą się jako cząstki elementarne w Twoim modelu:
- Kulki z plasteliny: To chyba najpopularniejszy wybór. Łatwo się formują i łączą.
- Kulki styropianowe: Dostępne w różnych rozmiarach, idealne do malowania.
- Koraliki: Jeśli masz w domu zapasy, mogą być świetną opcją.
- Pompony: Lekkie i kolorowe, dodadzą modelowi miękkości.
- Produkty spożywcze: Na przykład suszona żurawina, ciecierzyca, fasola to opcja dla tych, którzy lubią ekologiczne rozwiązania.
Bardzo ważne: Musisz użyć trzech różnych kolorów jeden dla protonów, jeden dla neutronów i jeden dla elektronów. Dzięki temu Twój model będzie czytelny i poprawny!
Szkielet modelu: Z czego zrobić orbity, by były stabilne?
Orbity to ścieżki, po których krążą elektrony. Muszą być stabilne i wyraźne:
- Drut kreatywny (chenille stems): Elastyczny, łatwy do formowania i dostępny w wielu kolorach. To mój ulubiony wybór.
- Patyczki do szaszłyków lub wykałaczki: Można z nich zbudować bardziej geometryczne, sztywne orbity.
- Wycięte z kartonu okręgi: Jeśli wolisz płaski model lub potrzebujesz bardzo sztywnych orbit, karton będzie dobrym rozwiązaniem.
Pamiętaj, że orbity powinny być na tyle sztywne, aby utrzymać kształt i elektrony.
Dodatkowe narzędzia, które ułatwią Ci pracę (klej, nożyczki, podstawa)
Te drobiazgi sprawią, że praca będzie przyjemniejsza i efektywniejsza:
- Klej: Najlepiej sprawdzi się klej na gorąco (pod nadzorem dorosłych!) lub mocny klej uniwersalny, który szybko schnie.
- Nożyczki/cążki: Do cięcia drutu lub kartonu.
- Taśma klejąca: Czasem przydaje się do tymczasowego mocowania.
- Stabilna podstawa: Kawałek grubego kartonu, styropianu, deseczka coś, co pozwoli Twojemu atomowi dumnie stać na biurku.
Budujemy model atomu węgla 3D: Instrukcja krok po kroku
Teraz, gdy masz już wszystkie materiały, czas zabrać się do pracy! Pamiętaj, że precyzja jest kluczem, ale nie bój się eksperymentować z materiałami, które masz pod ręką. Zaczynamy od serca atomu jądra.
Krok 1: Tworzymy serce atomu, czyli jądro atomowe
Jądro to centralna i najważniejsza część atomu. Musi być zwarte i stabilne.
Ile kulek i w jakich kolorach? Przygotowanie protonów i neutronów
Zacznij od przygotowania kulek na protony i neutrony. Potrzebujesz 6 kulek w jednym kolorze (np. czerwonym) na protony i 6 kulek w innym kolorze (np. niebieskim) na neutrony. Upewnij się, że kolory są wyraźnie różne od koloru, który zarezerwujesz dla elektronów. Kulki powinny być mniej więcej tej samej wielkości, aby jądro wyglądało estetycznie. Ja zawsze staram się, żeby były w miarę równe.
Jak trwale połączyć cząstki w jedno, stabilne jądro?
Teraz połącz wszystkie 6 protonów i 6 neutronów w jedną, zwartą bryłę. Możesz to zrobić na kilka sposobów:
- Jeśli używasz plasteliny, po prostu uformuj z nich jedną kulę, mieszając kolory lub układając je naprzemiennie.
- W przypadku kulek styropianowych, koralików czy pomponów, użyj kleju na gorąco (z pomocą dorosłych!) lub mocnego kleju uniwersalnego. Możesz też użyć krótkich kawałków wykałaczek, aby je ze sobą spiąć, a następnie dodatkowo skleić.
Jądro powinno być stabilne i zwarte, aby nie rozpadło się w trakcie dalszych prac czy transportu do szkoły.
Krok 2: Konstrukcja orbit dla elektronów
Orbity to niewidzialne ścieżki elektronów, ale w naszym modelu musimy je fizycznie przedstawić. Będą to dwie okrągłe powłoki.
Jak uformować idealnie okrągłe powłoki elektronowe z drutu?
Jeśli wybrałeś drut kreatywny, uformuj z niego dwie okrągłe pętle. Jedna będzie mniejsza (na pierwszą powłokę), a druga większa (na drugą powłokę). Upewnij się, że są na tyle duże, aby bez problemu pomieścić odpowiednią liczbę elektronów, ale też nie za duże, by model nie był zbyt rozłożysty. Końce drutu możesz skręcić lub skleić, aby pętle były stabilne. Staraj się, aby były jak najbardziej okrągłe to dodaje estetyki.
Alternatywa dla drutu: Jak wykorzystać karton lub patyczki?
Jeśli nie masz drutu, możesz wyciąć dwa okręgi z grubego kartonu jeden mniejszy, drugi większy. Możesz też spróbować połączyć patyczki do szaszłyków lub wykałaczki, tworząc z nich szkielet okręgów. W tym przypadku będziesz potrzebować kleju, aby utrzymać konstrukcję w ryzach. Pamiętaj, aby kartonowe okręgi były sztywne, żeby się nie zginały pod ciężarem elektronów.
Krok 3: Rozmieszczanie elektronów tutaj nie ma miejsca na pomyłkę!
To jeden z najważniejszych etapów, bo prawidłowe rozmieszczenie elektronów świadczy o zrozumieniu budowy atomu. Potrzebujesz 6 kulek w trzecim, odmiennym kolorze (np. zielonym) na elektrony.
Pierwsza orbita: Jak poprawnie umieścić 2 elektrony?
Weź mniejszą orbitę (tę wewnętrzną). Przymocuj do niej 2 elektrony. Rozmieść je w miarę równomiernie, na przykład po przeciwnych stronach orbity. Użyj kleju, aby elektrony były stabilnie przymocowane i nie spadały. To bardzo ważne, aby na tej powłoce były dokładnie dwa elektrony ani mniej, ani więcej!
Druga orbita: Gdzie dokładnie przymocować 4 elektrony walencyjne?
Teraz zajmij się większą orbitą (tą zewnętrzną). Przymocuj do niej pozostałe 4 elektrony. Również postaraj się rozmieścić je równomiernie wokół orbity. Te cztery elektrony to elektrony walencyjne, które są kluczowe dla właściwości chemicznych węgla. Ich poprawne umieszczenie jest absolutnie niezbędne dla merytorycznej poprawności Twojego modelu.Krok 4: Wielki finał, czyli składamy wszystko w całość
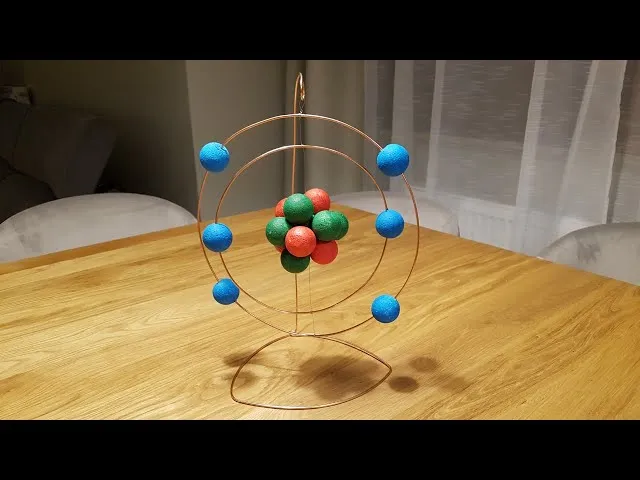
Masz już jądro i dwie orbity z elektronami. Czas połączyć je w jeden, przestrzenny model atomu węgla.
Jak przymocować orbity do jądra, by model był czytelny i estetyczny?
Przymocuj mniejszą orbitę do jądra, a następnie większą orbitę. Najlepiej, jeśli orbity będą ułożone pod różnymi kątami względem siebie. Dzięki temu model będzie wyglądał bardziej przestrzennie i dynamicznie, a nie jak płaski obrazek. Użyj kleju (na gorąco lub uniwersalnego) do stabilnego połączenia. Możesz też użyć krótkich kawałków drutu lub wykałaczek, aby dodatkowo wzmocnić mocowanie orbit do jądra. Moja rada: spróbuj ułożyć je tak, aby każdy elektron był dobrze widoczny i nie zasłaniał go inny element.
Stawiamy na nogi: Jak stworzyć stabilną podstawę dla Twojego modelu?
Ostatni szlif to podstawa. Przymocuj cały gotowy model do stabilnej podstawy, np. kawałka styropianu, grubego kartonu, czy małej deseczki. Możesz wbić w jądro kawałek patyczka do szaszłyków, a drugi koniec patyczka wbić w podstawę. Upewnij się, że model stoi stabilnie i nie przewraca się. Możesz też ozdobić podstawę, np. napisać na niej "Atom Węgla - ¹²C" i swoje imię. To zawsze dodaje profesjonalnego wyglądu.
Kreatywne pomysły: Jak nadać modelowi wyjątkowy charakter?
Standardowy model to świetny początek, ale jeśli masz ochotę pójść o krok dalej i naprawdę zaskoczyć nauczyciela, mam dla Ciebie kilka pomysłów, które pozwolą Ci wyróżnić się z tłumu.
Model z plasteliny i wykałaczek: Najprostsza i najszybsza metoda
Jeśli czas goni, a Ty potrzebujesz czegoś prostego, postaw na plastelinę i wykałaczki. Z plasteliny uformuj kulki na protony, neutrony i elektrony (pamiętaj o trzech kolorach!). Jądro możesz stworzyć, łącząc kulki plasteliny wykałaczkami, a same wykałaczki mogą symbolizować orbity, do których przyczepisz elektrony. To szybkie, efektywne i pozwala na dużą swobodę w formowaniu. Z mojego doświadczenia wiem, że nawet takie proste modele, jeśli są wykonane starannie, potrafią zrobić wrażenie.
Model "eko": Jak wykorzystać materiały z recyklingu?
Chcesz być eko i pokazać swoją pomysłowość? Wykorzystaj materiały z recyklingu!
- Kulki z papieru: Zgnieć stare gazety lub ulotki, uformuj kulki i pomaluj je na odpowiednie kolory.
- Nakrętki od butelek: Mogą posłużyć jako protony, neutrony lub elektrony wystarczy je pomalować.
- Kawałki styropianu z opakowań: Wytnij z nich kulki lub inne kształty.
- Pudełka po jajkach: Mogą być podstawą lub elementami orbit.
Pamiętaj, że nawet z pozornie niepotrzebnych rzeczy można stworzyć coś naprawdę wyjątkowego!
Efekt "wow": Pomysły na wiszący, mobilny model atomu
Jeśli masz więcej czasu i ochoty na wyzwanie, pomyśl o modelu, który będzie naprawdę dynamiczny:
- Wiszący model (mobil): Zamiast sztywnych orbit, użyj żyłki wędkarskiej. Przymocuj do niej elektrony i zawieś je wokół jądra, tworząc efekt swobodnego "krążenia". Jądro również może wisieć na żyłce. To wygląda bardzo efektownie!
- Model z diodami LED: Dla prawdziwych majsterkowiczów! Możesz wbudować małe diody LED w elektrony, które będą świecić, symbolizując energię. To już wyższa szkoła jazdy, ale efekt jest niesamowity.
Takie kreatywne podejście z pewnością zostanie docenione i pokaże Twoje zaangażowanie.
Unikaj tych błędów: Najczęstsze pułapki przy budowie modelu
Nawet najlepsi popełniają błędy, ale dzięki moim wskazówkom możesz ich uniknąć. Zwróć uwagę na te najczęstsze pułapki, które mogą obniżyć ocenę Twojego modelu.
Pomyłka w liczbie cząstek: Jak podwójnie sprawdzić swój model?
To najczęstszy i najbardziej podstawowy błąd. Pamiętaj, że model węgla-¹² musi mieć dokładnie 6 protonów, 6 neutronów i 6 elektronów. Zawsze, zanim zaczniesz składać model, policz kulki! Stwórz sobie małą listę kontrolną: "6 czerwonych (protony), 6 niebieskich (neutrony), 6 zielonych (elektrony)". Podwójne sprawdzenie zajmie Ci minutę, a może uratować Ci ocenę.
Złe rozmieszczenie elektronów: Dlaczego to najpoważniejszy błąd?
Nawet jeśli masz dobrą liczbę elektronów, ich złe rozmieszczenie to poważny błąd merytoryczny. Zapamiętaj raz na zawsze: 2 elektrony na pierwszej powłoce i 4 elektrony na drugiej (walencyjnej) powłoce. Nigdy nie umieszczaj więcej niż 2 elektronów na wewnętrznej powłoce! To kluczowa zasada chemii, która decyduje o tym, jak atom reaguje. Nauczyciele zwracają na to szczególną uwagę, bo to świadczy o zrozumieniu tematu.
Przeczytaj również: Niepewność pomiaru w fizyce: Co to? Obliczaj i zapisuj wyniki!
Niestabilna konstrukcja: Co zrobić, żeby model się nie rozpadł przed lekcją?
Wyobraź sobie, że spędzasz godziny na budowie, a model rozpada się w drodze do szkoły. To koszmar! Aby tego uniknąć:
- Używaj mocnego kleju i daj mu wystarczająco dużo czasu na wyschnięcie.
- Upewnij się, że materiały na orbity są sztywne i dobrze przymocowane do jądra.
- Zawsze montuj model na stabilnej podstawie.
- Przed transportem do szkoły, wykonaj "test wstrząsowy" delikatnie potrząśnij modelem, aby sprawdzić, czy wszystkie elementy są dobrze zamocowane. Jeśli coś się rusza, popraw to od razu!
Pamiętaj, że solidność wykonania to podstawa, by Twój wysiłek nie poszedł na marne.