W świecie chemii, gdzie cząsteczki nieustannie oddziałują ze sobą, zrozumienie pojęcia dipola jest absolutnie fundamentalne. To właśnie ten pozornie prosty układ dwóch różnoimiennych ładunków elektrycznych w cząsteczce decyduje o wielu kluczowych właściwościach substancji, od ich rozpuszczalności po temperatury wrzenia i topnienia. Jako Daniel Kowalski, postaram się wyjaśnić to zjawisko w sposób przystępny, pokazując, jak dipole kształtują otaczający nas świat.
Czym jest dipol i jak wpływa na chemię substancji?
- Dipol to układ dwóch różnoimiennych, częściowych ładunków elektrycznych w cząsteczce, powstały na skutek nierównomiernego rozłożenia elektronów.
- Kluczowym czynnikiem decydującym o polarności wiązania jest różnica elektroujemności między atomami.
- Moment dipolowy (μ) to wektorowa miara polarności całej cząsteczki, zależna od polarności wiązań i jej budowy przestrzennej.
- Wyróżniamy dipole trwałe (w cząsteczkach polarnych, np. H₂O) oraz chwilowe (indukowane, w cząsteczkach niepolarnych).
- Symetryczna budowa cząsteczki może znosić momenty dipolowe wiązań, czyniąc całą cząsteczkę niepolarną (np. CO₂).
- Obecność dipoli znacząco wpływa na właściwości fizyczne substancji, takie jak rozpuszczalność, temperatury wrzenia i topnienia oraz oddziaływania międzycząsteczkowe.
Dipol w chemii: najprostsze wyjaśnienie zjawiska
Czym jest dipol? Definicja bez skomplikowanego żargonu
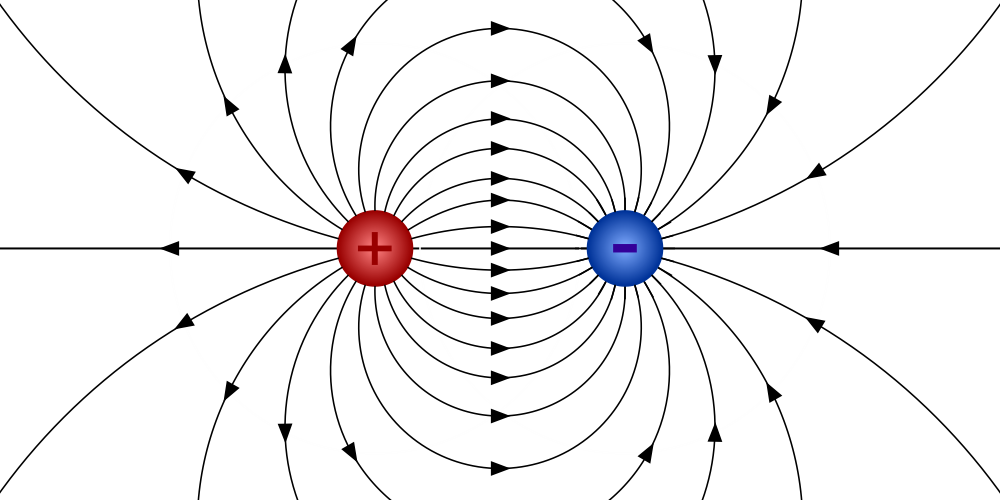
W najprostszym ujęciu, dipol to układ dwóch ładunków elektrycznych o tej samej wartości, ale przeciwnym znaku (jeden dodatni, drugi ujemny), które są od siebie oddalone. Wyobraź sobie magnes, który zawsze ma dwa bieguny północny i południowy. Podobnie w chemii, w cząsteczce może powstać taki "magnetyczny" układ, gdzie jedna jej część ma charakter lekko dodatni, a druga lekko ujemny. W kontekście chemicznym, dipol powstaje w cząsteczkach na skutek nierównomiernego rozłożenia elektronów, co prowadzi do utworzenia się takich właśnie dwóch biegunów.
Dwa bieguny w jednej cząsteczce: skąd biorą się ładunki dodatnie i ujemne?
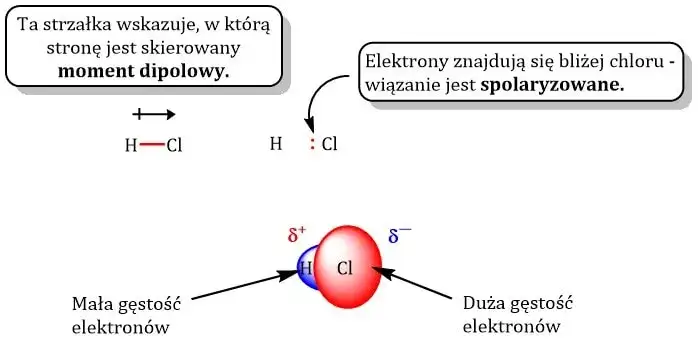
Warto od razu zaznaczyć, że w przypadku dipoli chemicznych nie mówimy o pełnych ładunkach jonowych, jak w przypadku jonów Na⁺ czy Cl⁻. Tutaj mamy do czynienia z ładunkami częściowymi, które oznaczamy grecką literą delta: δ⁺ (delta plus) i δ⁻ (delta minus). Powstają one, gdy elektrony tworzące wiązanie kowalencyjne nie są dzielone równo między dwa atomy. Jeden z atomów, będąc bardziej "chciwym" na elektrony, przyciąga je do siebie silniej, co powoduje przesunięcie chmury elektronowej w jego kierunku. W efekcie, atom ten zyskuje częściowy ładunek ujemny (δ⁻), a atom, od którego elektrony zostały odciągnięte, staje się częściowo dodatni (δ⁺). To właśnie to przesunięcie tworzy te dwa bieguny w cząsteczce.
Klucz do polarności: dlaczego elektroujemność jest tak ważna?
Skala Paulinga w praktyce: jak różnica elektroujemności tworzy dipol?
Zdolność atomu do przyciągania elektronów w wiązaniu chemicznym nazywamy elektroujemnością. To kluczowe pojęcie, które pozwala nam przewidywać, czy wiązanie będzie polarne. Najczęściej posługujemy się skalą Paulinga, która przypisuje wartości elektroujemności poszczególnym pierwiastkom. Kiedy dwa atomy łączą się ze sobą, musimy spojrzeć na różnicę ich elektroujemności (ΔE). Jeśli ta różnica jest znacząca, elektrony są nierównomiernie dzielone, a wiązanie staje się kowalencyjne spolaryzowane. Przyjmuje się, że dla ΔE w zakresie od 0,4 do 1,7 mamy do czynienia z takim właśnie wiązaniem, które jest niczym innym jak małym dipolem w obrębie cząsteczki.
Od wiązania atomowego do kowalencyjnego spolaryzowanego: ewolucja wiązania
Gdy różnica elektroujemności (ΔE) między dwoma atomami jest bardzo mała (bliska zeru, np. ΔE < 0,4), elektrony są dzielone niemal idealnie równo. Mówimy wtedy o wiązaniu kowalencyjnym niespolaryzowanym. Klasycznym przykładem jest wiązanie w cząsteczce wodoru (H-H) czy chloru (Cl-Cl).
Na drugim końcu spektrum, gdy różnica elektroujemności jest bardzo duża (ΔE > 1,7), jeden atom tak silnie przyciąga elektrony, że praktycznie je "zabiera" od drugiego. Wtedy powstaje wiązanie jonowe, gdzie mamy do czynienia z pełnymi ładunkami, a nie częściowymi. Przykładem jest chlorek sodu (Na-Cl).
Pomiędzy tymi skrajnościami leży wiązanie kowalencyjne spolaryzowane to właśnie w nim elektrony są dzielone, ale nierównomiernie, tworząc częściowe ładunki i tym samym dipol w obrębie wiązania. Doskonałym przykładem jest wiązanie w chlorowodorze (H-Cl), gdzie chlor jest znacznie bardziej elektroujemny niż wodór.
Moment dipolowy: matematyczny dowód na istnienie dipolu
Co mówi nam wektor momentu dipolowego?
Aby ilościowo opisać polarność cząsteczki, chemicy posługują się pojęciem momentu dipolowego (μ). To nie tylko liczba, ale wektorowa miara, co oznacza, że ma zarówno wartość, jak i kierunek. Kierunek wektora momentu dipolowego zawsze wskazuje w stronę bieguna ujemnego, czyli w stronę bardziej elektroujemnego atomu. Długość tego wektora odzwierciedla siłę polarności im dłuższy wektor, tym silniejszy dipol i większa polarność cząsteczki. To narzędzie pozwala nam precyzyjnie analizować rozkład ładunków.
Wzór i jednostki: jak chemicy mierzą polarność cząsteczek?
Moment dipolowy (μ) jest definiowany jako iloczyn wartości ładunku (q) i odległości (l) między środkami tych ładunków. Matematycznie wyraża się to wzorem:
μ = q · l
W układzie SI jednostką momentu dipolowego jest kulombometr (C·m). Jednak w chemii znacznie częściej używamy jednostki zwanej debajem (D), nazwanej na cześć Petera Debye'a. Warto zapamiętać przelicznik: 1 D ≈ 3,33564 × 10⁻³⁰ C·m. Ta jednostka jest wygodniejsza, ponieważ wartości momentów dipolowych dla typowych cząsteczek chemicznych wyrażone w debajach są małymi, ale łatwymi do operowania liczbami.
Trwały czy chwilowy? Poznaj dwa oblicza chemicznego dipolu
Dipol trwały: cecha charakterystyczna cząsteczek polarnych (np. H₂O, HCl)
Dipol trwały, nazywany również permanentnym, jest stałą cechą cząsteczek polarnych. Powstaje on w wyniku trwałego, nierównomiernego rozkładu elektronów, który jest konsekwencją różnic w elektroujemności atomów tworzących wiązania oraz asymetrycznej budowy przestrzennej cząsteczki. Takie cząsteczki mają wyraźny biegun dodatni i ujemny, które istnieją niezależnie od otoczenia. Klasyczne przykłady to woda (H₂O), chlorowodór (HCl) czy amoniak (NH₃). To właśnie obecność tych trwałych dipoli decyduje o wielu unikalnych właściwościach tych substancji, takich jak wysoka temperatura wrzenia wody.
Dipol indukowany (chwilowy): ukryta polarność cząsteczek niepolarnych (np. Cl₂)
Zupełnie innym zjawiskiem jest dipol chwilowy, zwany również indukowanym. Powstaje on w cząsteczkach, które same w sobie są niepolarne (czyli nie mają trwałego dipola). Nawet w takich cząsteczkach, elektrony nie stoją w miejscu nieustannie się poruszają. W wyniku tych losowych, krótkotrwałych fluktuacji w rozkładzie chmury elektronowej, przez ułamek sekundy może pojawić się chwilowa asymetria ładunku, tworząc tym samym krótkotrwały dipol. Co ciekawe, taki chwilowy dipol może indukować, czyli wymuszać, powstanie dipola w sąsiedniej, również niepolarnej cząsteczce. Te słabe, ale wszechobecne oddziaływania nazywamy siłami dyspersyjnymi Londona i są one odpowiedzialne za skraplanie się gazów szlachetnych czy cząsteczek takich jak wodór (H₂), chlor (Cl₂) czy metan (CH₄).
Geometria ma znaczenie: kiedy cząsteczka staje się dipolem?
Symetria, która niweczy wszystko: dlaczego CO₂ i CCl₄ nie są dipolami, mimo polarnych wiązań?
To jest jeden z tych momentów w chemii, który często zaskakuje moich studentów. Można by pomyśleć, że jeśli cząsteczka ma polarne wiązania, to musi być polarna jako całość. Nic bardziej mylnego! Polarność całej cząsteczki zależy nie tylko od polarności poszczególnych wiązań, ale przede wszystkim od jej budowy przestrzennej. W cząsteczkach o wysoce symetrycznej geometrii, takich jak liniowy dwutlenek węgla (CO₂) czy tetraedryczny tetrachlorometan (CCl₄), wektory momentów dipolowych poszczególnych wiązań (np. C=O w CO₂ czy C-Cl w CCl₄) są skierowane w taki sposób, że znoszą się wzajemnie. Ich suma wektorowa wynosi zero, co sprawia, że mimo obecności polarnych wiązań, cała cząsteczka jest niepolarna. To trochę jak przeciąganie liny przez dwie równie silne drużyny mimo wysiłku, lina pozostaje w miejscu.
Krok po kroku: jak ocenić, czy cząsteczka jest polarna?
Oto prosty algorytm, który pomoże Ci ocenić polarność cząsteczki:
- Sprawdź polarność wiązań: Na początek oceń różnicę elektroujemności między atomami tworzącymi wiązania w cząsteczce. Jeśli ΔE jest w zakresie 0,4-1,7, wiązania są polarne. Jeśli wszystkie wiązania są niespolaryzowane, cała cząsteczka jest niepolarna.
- Określ budowę przestrzenną cząsteczki: Ustal geometrię cząsteczki (np. liniowa, kątowa, tetraedryczna, piramidalna). Jest to kluczowe, ponieważ decyduje o ułożeniu wektorów momentów dipolowych.
- Oceń wektorową sumę momentów dipolowych: Jeśli cząsteczka ma polarne wiązania i jej budowa jest asymetryczna (np. kątowa jak woda, piramidalna jak amoniak), wektory momentów dipolowych wiązań nie zniosą się, a cząsteczka będzie polarna. Jeśli natomiast budowa jest symetryczna (np. liniowa CO₂, tetraedryczna CCl₄), wektory te zniosą się, a cząsteczka będzie niepolarna.
Przykłady cząsteczek polarnych i niepolarnych, które warto zapamiętać
Przyjrzyjmy się kilku popularnym cząsteczkom, aby utrwalić tę wiedzę:
| Cząsteczka | Typ polarności i krótkie uzasadnienie |
|---|---|
| H₂O (woda) | Polarna. Posiada polarne wiązania O-H i kątową budowę, co sprawia, że momenty dipolowe wiązań nie znoszą się. |
| CO₂ (dwutlenek węgla) | Niepolarna. Posiada polarne wiązania C=O, ale liniową, symetryczną budowę, przez co momenty dipolowe znoszą się. |
| NH₃ (amoniak) | Polarna. Posiada polarne wiązania N-H i piramidalną budowę, co prowadzi do wypadkowego momentu dipolowego. |
| CH₄ (metan) | Niepolarna. Posiada słabo polarne wiązania C-H (ΔE jest małe) i tetraedryczną, symetryczną budowę, przez co momenty dipolowe znoszą się. |
| CCl₄ (tetrachlorometan) | Niepolarna. Posiada polarne wiązania C-Cl, ale tetraedryczną, symetryczną budowę, przez co momenty dipolowe znoszą się. |
| HCl (chlorowodór) | Polarna. Posiada jedno bardzo polarne wiązanie H-Cl i liniową budowę, co czyni ją polarną. |
Dlaczego dipole są tak istotne? Wpływ polarności na świat wokół nas
Zasada "podobne rozpuszcza podobne": rola dipoli w rozpuszczalności
Jedną z najważniejszych konsekwencji istnienia dipoli jest zasada "podobne rozpuszcza podobne" (like dissolves like). Oznacza to, że substancje polarne najlepiej rozpuszczają się w rozpuszczalnikach polarnych, a substancje niepolarne w rozpuszczalnikach niepolarnych. Dlaczego tak się dzieje? Cząsteczki polarne, dzięki swoim biegunom, mogą efektywnie oddziaływać z innymi cząsteczkami polarnymi, otaczając je i "wyrywając" z sieci krystalicznej lub z innych oddziaływań. To dlatego alkohole (cząsteczki polarne) doskonale mieszają się z wodą (również polarną). Z kolei tłuszcze i oleje (substancje niepolarne) nie rozpuszczają się w wodzie, ale świetnie rozpuszczają się w niepolarnych rozpuszczalnikach, takich jak benzyna czy eter.
Jak dipole wpływają na temperaturę wrzenia i topnienia substancji?
Obecność trwałych dipoli w cząsteczkach ma ogromny wpływ na ich temperatury wrzenia i topnienia. Cząsteczki polarne, posiadając częściowe ładunki, mogą tworzyć między sobą dodatkowe oddziaływania tak zwane oddziaływania dipol-dipol. Są to siły przyciągania elektrostatycznego między dodatnim biegunem jednej cząsteczki a ujemnym biegunem drugiej. Aby substancja przeszła ze stanu ciekłego w gazowy (wrzenie) lub ze stałego w ciekły (topnienie), trzeba dostarczyć energię wystarczającą do zerwania tych oddziaływań międzycząsteczkowych. Im silniejsze są te oddziaływania, tym więcej energii jest potrzebne. Dlatego też, substancje polarne mają zazwyczaj wyższe temperatury wrzenia i topnienia w porównaniu do substancji niepolarnych o podobnej masie cząsteczkowej, ponieważ w tych drugich występują jedynie słabsze siły dyspersyjne Londona.
Przeczytaj również: Model atomu na 6: Z czego zrobić? Pomysły i instrukcje