Woda, ta pozornie prosta substancja, jest absolutnie niezbędna do życia na Ziemi. Jej unikalne właściwości, od zdolności do rozpuszczania wielu substancji po niezwykłe zachowanie lodu, wynikają bezpośrednio z jej mikroskopijnej budowy. W tym artykule zanurzymy się w świat cząsteczki H₂O, aby odkryć, ile atomów ją tworzy i dlaczego ta z pozoru prosta struktura ma tak fundamentalne znaczenie dla całego naszego świata.
Cząsteczka wody H₂O: Ile atomów tworzy ten fundament życia?
- Cząsteczka wody (H₂O) składa się z trzech atomów.
- W jej skład wchodzą dwa atomy wodoru (H) i jeden atom tlenu (O).
- Wzór H₂O symbolizuje tę prostą, lecz niezwykle ważną budowę.
- Woda ma kątową budowę (w kształcie litery V) z kątem około 104,5 stopnia.
- Polarność cząsteczki i zdolność do tworzenia wiązań wodorowych nadają wodzie unikalne właściwości.
- Te właściwości są kluczowe dla istnienia i podtrzymywania życia na Ziemi.
Ile atomów tworzy cząsteczkę wody? Szybka odpowiedź
Zacznijmy od sedna sprawy: cząsteczka wody, oznaczana chemicznym wzorem H₂O, składa się z trzech atomów. Są to dokładnie dwa atomy wodoru (H) i jeden atom tlenu (O). To właśnie ta konkretna kombinacja i proporcja atomów nadaje wodzie jej wszystkie, tak dobrze nam znane, właściwości.
Wzór H₂O bez tajemnic: Co oznaczają litery i cyfry?
Wzór H₂O jest jednym z najbardziej rozpoznawalnych symboli chemicznych na świecie, ale co dokładnie oznaczają te litery i cyfry? Litera "H" to symbol chemiczny pierwiastka wodoru (łac. hydrogenium), a "O" to symbol chemiczny tlenu (łac. oxygenium). Mała cyfra "2" umieszczona jako indeks dolny obok "H" informuje nas o liczbie atomów danego pierwiastka w cząsteczce. W tym przypadku oznacza to, że w jednej cząsteczce wody znajdują się dwa atomy wodoru. Brak indeksu dolnego przy "O" oznacza, że jest tam tylko jeden atom tlenu. Proste, prawda?
Dwa atomy wodoru i jeden tlenu: Prosta budowa o ogromnym znaczeniu
Ta z pozoru prosta budowa dwa atomy wodoru i jeden tlenu jest absolutnie kluczowa. To właśnie ona, w połączeniu ze sposobem, w jaki te atomy są ze sobą połączone, decyduje o wszystkich unikalnych właściwościach wody. Bez tej specyficznej konfiguracji, woda nie byłaby tym, czym jest, a życie na Ziemi, jakie znamy, prawdopodobnie by nie istniało. W kolejnych sekcjach zagłębimy się w to, jak te atomy łączą się ze sobą i dlaczego ma to tak ogromne znaczenie.
Jak atomy łączą się w cząsteczkę wody? Klucz do jej niezwykłych właściwości
Zrozumienie, ile atomów tworzy cząsteczkę wody, to dopiero początek. Prawdziwa magia kryje się w sposobie, w jaki te atomy są ze sobą połączone. To właśnie rodzaj wiązań chemicznych i przestrzenna geometria cząsteczki wody są źródłem jej niezwykłych właściwości, które sprawiają, że jest ona tak wyjątkowa.
Wiązania kowalencyjne spolaryzowane: Dlaczego tlen "przyciąga" mocniej?
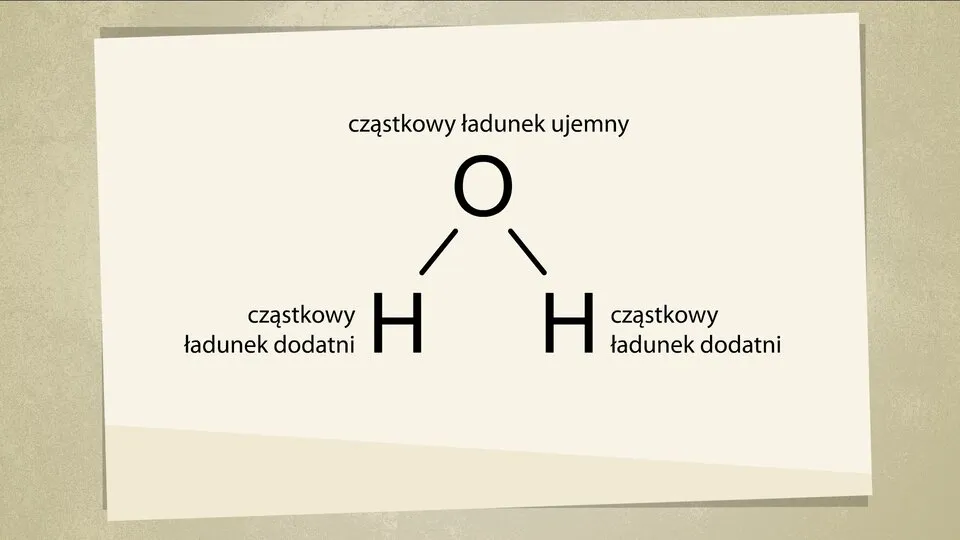
W cząsteczce wody atomy wodoru i tlenu są połączone za pomocą wiązań kowalencyjnych spolaryzowanych. Co to oznacza? Wiązanie kowalencyjne polega na uwspólnianiu elektronów między atomami. Jednak w przypadku wody, atom tlenu jest znacznie bardziej elektroujemny niż atomy wodoru. Elektroujemność to nic innego jak zdolność atomu do przyciągania elektronów w wiązaniu chemicznym. Ponieważ tlen jest silniejszy w tym "przeciąganiu liny" o elektrony, te spędzają więcej czasu w pobliżu jądra tlenu, a mniej w pobliżu jąder wodoru. To nierównomierne rozmieszczenie elektronów prowadzi do powstania cząstkowych ładunków tlen zyskuje cząstkowy ładunek ujemny (δ-), a wodory cząstkowe ładunki dodatnie (δ+).
Kształt litery "V": Nietypowa budowa, która zmienia wszystko
Kolejnym kluczowym elementem jest geometria cząsteczki wody. Wbrew pozorom, nie jest ona liniowa, jak na przykład cząsteczka dwutlenku węgla (O=C=O). Cząsteczka wody ma budowę kątową, często opisywaną jako kształt litery "V" lub zagięty. Atom tlenu znajduje się w wierzchołku, a dwa atomy wodoru są do niego przyłączone pod pewnym kątem. Ta nietypowa, nieliniowa geometria jest absolutnie fundamentalna dla polarności cząsteczki wody, o której opowiem za chwilę.
Kąt 104, 5°: Dlaczego ta precyzyjna geometria jest tak ważna?
Precyzyjny kąt między wiązaniami H-O-H w cząsteczce wody wynosi około 104,5 stopnia (w fazie ciekłej). Ten konkretny kąt, w połączeniu z nierównomiernym rozkładem ładunków, sprawia, że cząsteczka wody jest dipolem. Oznacza to, że ma wyraźnie zdefiniowany biegun dodatni (strona z atomami wodoru) i biegun ujemny (strona z atomem tlenu). Gdyby cząsteczka wody była liniowa, jak CO₂, jej ładunki cząstkowe wzajemnie by się znosiły, a woda straciłaby swoje polarne właściwości. To właśnie ta precyzyjna, kątowa geometria jest kluczowa dla jej "magnetycznych" zdolności.
Magia polarności: Woda jak mały magnes
Mając na uwadze to, co już wiemy o wiązaniach i geometrii, możemy teraz zrozumieć jedno z najważniejszych pojęć dotyczących wody: jej polarność. Cząsteczka wody działa jak maleńki magnes, posiadający dwa bieguny jeden dodatni i jeden ujemny. To właśnie ta "magnetyczna" natura sprawia, że woda jest tak wyjątkowa.
Dipol, czyli dwa bieguny: Jak powstaje cząstkowy ładunek dodatni i ujemny?
Jak już wspomniałem, ze względu na większą elektroujemność tlenu, elektrony w wiązaniach H-O są przesunięte w jego stronę. To sprawia, że atom tlenu uzyskuje cząstkowy ładunek ujemny (δ-), podczas gdy atomy wodoru, pozbawione części elektronów, uzyskują cząstkowe ładunki dodatnie (δ+). Ponieważ cząsteczka wody ma kształt litery "V", te cząstkowe ładunki nie znoszą się wzajemnie, co prowadzi do powstania dipola elektrycznego. Mówiąc prościej, jedna strona cząsteczki jest lekko ujemna, a druga lekko dodatnia. To jak miniaturowy magnes, który ma swoje "plusy" i "minusy".
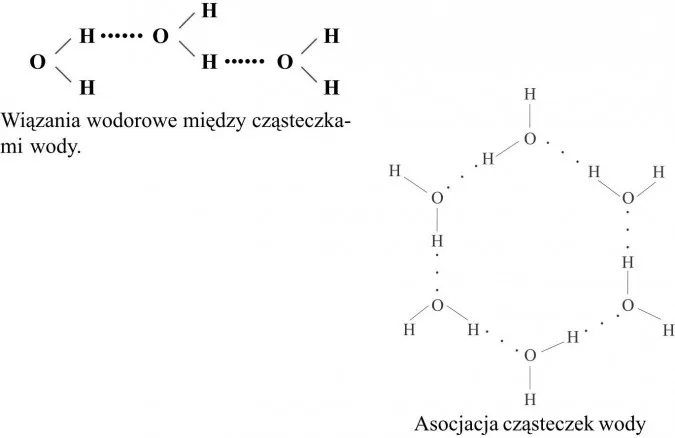
Wiązania wodorowe: Niewidzialna siła łącząca cząsteczki wody
Polarność cząsteczek wody ma kolosalne konsekwencje. Dzięki niej, poszczególne cząsteczki H₂O mogą wzajemnie się przyciągać. Dodatnio naładowane atomy wodoru jednej cząsteczki są przyciągane przez ujemnie naładowany atom tlenu innej cząsteczki. Te słabe, ale liczne oddziaływania nazywamy wiązaniami wodorowymi. Są one znacznie słabsze niż wiązania kowalencyjne wewnątrz cząsteczki, ale ich ogromna liczba w masie wody sprawia, że są one niezwykle ważne. To właśnie wiązania wodorowe są odpowiedzialne za wiele unikalnych właściwości wody, które omówimy za chwilę.
Dlaczego woda jest "uniwersalnym rozpuszczalnikiem"?
Polarna natura cząsteczki wody sprawia, że jest ona doskonałym rozpuszczalnikiem dla wielu substancji. Mówimy o niej często "uniwersalny rozpuszczalnik", choć oczywiście nie rozpuszcza wszystkiego. Dlaczego tak jest? Cząsteczki wody, dzięki swoim biegunom, potrafią otaczać i "rozrywać" cząsteczki innych substancji polarnych lub jonowych. Weźmy przykład soli kuchennej (chlorku sodu, NaCl). Kiedy wrzucimy sól do wody, dodatnie bieguny cząsteczek wody otaczają jony chlorkowe (Cl-), a ujemne bieguny otaczają jony sodowe (Na+), skutecznie rozdzielając je i rozpuszczając sól. To kluczowa właściwość dla procesów biologicznych i chemicznych na Ziemi.
Jak budowa cząsteczki H₂O wpływa na świat?
Omówiliśmy już, ile atomów ma cząsteczka wody i jak są one połączone. Teraz nadszedł czas, aby zobaczyć, jak te podstawowe fakty przekładają się na niezwykłe zjawiska, które obserwujemy w otaczającym nas świecie. To właśnie budowa cząsteczki H₂O i wynikające z niej właściwości kształtują środowisko i podtrzymują życie.
Anomalia gęstości: Tajemnica, dzięki której lód unosi się na wodzie
Jedną z najbardziej fascynujących właściwości wody jest jej anomalia gęstości. Większość substancji w stanie stałym jest gęstsza niż w stanie ciekłym. Woda jest inna. Lód (woda w stanie stałym) ma mniejszą gęstość niż woda w stanie ciekłym i dlatego unosi się na jej powierzchni. Co więcej, woda osiąga swoją największą gęstość w temperaturze 4°C. To zjawisko jest absolutnie fundamentalne dla życia w zbiornikach wodnych. Dzięki niemu, zimą lód tworzy się na powierzchni jezior i rzek, izolując głębsze warstwy wody i pozwalając organizmom wodnym przetrwać mrozy. Gdyby lód tonął, zbiorniki wodne zamarzałyby od dna do powierzchni, niszcząc życie.
Wysoka temperatura wrzenia: Jak wiązania wodorowe utrzymują wodę w stanie ciekłym?
Woda ma stosunkowo wysoką temperaturę wrzenia (100°C) i topnienia (0°C) w porównaniu do innych cząsteczek o podobnej masie. Jest to bezpośredni skutek obecności wiązań wodorowych. Aby woda przeszła ze stanu ciekłego w gazowy (zagotowała się), trzeba dostarczyć dużej ilości energii, aby zerwać te liczne wiązania wodorowe między cząsteczkami. Gdyby nie one, woda wrzałaby w znacznie niższej temperaturze, a w temperaturze pokojowej byłaby gazem. To właśnie dzięki wiązaniom wodorowym woda utrzymuje się w stanie ciekłym w szerokim zakresie temperatur, co jest kluczowe dla procesów biologicznych.
Napięcie powierzchniowe: Niezwykła spójność kropli wody
Czy kiedykolwiek zastanawiałeś się, dlaczego krople wody są okrągłe, a niektóre owady potrafią chodzić po jej powierzchni? Odpowiedzią jest napięcie powierzchniowe. Jest ono wynikiem silnych sił spójności (kohezji) między cząsteczkami wody, które są utrzymywane razem przez wiązania wodorowe. Cząsteczki na powierzchni wody są silnie przyciągane przez cząsteczki znajdujące się pod nimi i obok nich, tworząc rodzaj elastycznej "błony" na powierzchni. To zjawisko jest niezwykle ważne dla transportu wody w roślinach (kapilarność) i dla wielu ekosystemów.
Czy każda cząsteczka wody jest taka sama? Spojrzenie na izotopy
Choć mówimy o wodzie jako o H₂O, rzeczywistość jest nieco bardziej złożona. W przyrodzie występują różne odmiany atomów tego samego pierwiastka, nazywane izotopami. Dotyczy to również wodoru i tlenu, co prowadzi do istnienia różnych "typów" cząsteczek wody.
Czym jest "ciężka woda" (D₂O)?
Najbardziej znanym przykładem izotopowej odmiany wody jest tak zwana "ciężka woda" (D₂O). W zwykłej wodzie (H₂O) atomy wodoru to głównie prot (¹H), czyli atom wodoru z jednym protonem w jądrze. W ciężkiej wodzie, atomy wodoru zostały zastąpione przez jego cięższy izotop deuter (D lub ²H), który oprócz jednego protonu posiada również jeden neutron. Stąd nazwa D₂O dwa atomy deuteru i jeden atom tlenu.
Przeczytaj również: Myślę, że "Co to jest atom? Odkryj budulec świata od cząstek po energię!" będzie idealne.
Różnice we właściwościach: Jak izotopy wpływają na masę i zachowanie cząsteczki?
Zastąpienie lekkiego wodoru cięższym deuterem w cząsteczce wody, choć może wydawać się drobną zmianą, ma zauważalny wpływ na jej właściwości fizyczne. Ciężka woda ma większą masę cząsteczkową (około 20 u w porównaniu do 18 u dla H₂O). Skutkuje to nieco wyższymi temperaturami wrzenia i topnienia (np. D₂O wrze w około 101,4°C, a topi się w 3,8°C). Różnice te są subtelne, ale mają znaczenie w niektórych zastosowaniach naukowych i przemysłowych, na przykład w reaktorach jądrowych, gdzie ciężka woda jest używana jako moderator neutronów.
Trzy atomy w cząsteczce wody: Fundament życia
Podsumowując naszą podróż w głąb cząsteczki wody, widzimy, że jej budowa jest zarówno prosta, jak i niezwykle złożona w swoich konsekwencjach. Składająca się z zaledwie trzech atomów dwóch wodoru i jednego tlenu cząsteczka H₂O jest prawdziwym arcydziełem natury. Jej polarność, wynikająca z nierównomiernego rozkładu elektronów i kątowej geometrii, umożliwia tworzenie wiązań wodorowych. To właśnie te wiązania są odpowiedzialne za wszystkie unikalne właściwości wody: od wysokiej temperatury wrzenia, przez anomalię gęstości, po zdolność do bycia uniwersalnym rozpuszczalnikiem. Bez tej specyficznej struktury i wynikających z niej właściwości, życie na naszej planecie, w formie, jaką znamy, byłoby niemożliwe. Woda to nie tylko H₂O; to fundament, na którym zbudowany jest cały nasz świat.

