Atom, choć niewidzialny gołym okiem, jest fundamentalnym budulcem wszystkiego, co nas otacza od najmniejszej cząsteczki wody po ogromne galaktyki. Zrozumienie jego budowy to klucz do poznania zasad rządzących materią i energią w naszym wszechświecie. Właśnie dlatego tak ważne jest, aby przyjrzeć się mu z bliska, nawet jeśli jego "wygląd" okazuje się być znacznie bardziej złożony, niż moglibyśmy przypuszczać.
Atom: niewidzialny budulec, którego wygląd zaskakuje skalą i złożonością
- Atom to podstawowy składnik materii, składający się z dodatnio naładowanego jądra i ujemnie naładowanej chmury elektronowej.
- Jądro atomowe, choć niezwykle małe, skupia ponad 99,9% masy atomu i zawiera protony (dodatnie) oraz neutrony (obojętne).
- Elektrony krążą wokół jądra w obszarze zwanym chmurą elektronową, która nadaje atomowi jego rozmiar, a ich ruch jest opisywany probabilistycznie przez orbitale.
- Proporcje atomu są niewyobrażalne: jądro jest 10 000 do 100 000 razy mniejsze od całego atomu, co sprawia, że atom to w większości pusta przestrzeń.
- Nasze rozumienie "wyglądu" atomu ewoluowało od prostych modeli planetarnych do współczesnego, kwantowo-mechanicznego opisu opartego na prawdopodobieństwie.
Atom niewidzialny budulec, z którego składa się wszystko
W swojej istocie, atom to najmniejsza jednostka materii, która zachowuje właściwości danego pierwiastka chemicznego. To naprawdę fascynujące, że wszystko, co widzimy, dotykamy i czym oddychamy od powietrza, przez wodę, po nasze własne ciała jest zbudowane z tych niewidzialnych cząstek. Zrozumienie, jak atomy są zbudowane i jak się ze sobą łączą, jest absolutnie fundamentalne dla całej chemii i fizyki.
Krótka podróż w czasie: od niepodzielnej cząstki do złożonej struktury
Przez wieki nasze wyobrażenie o atomie zmieniało się diametralnie. Starożytni filozofowie, tacy jak Demokryt, wierzyli, że materia składa się z niepodzielnych, niezmiennych cząstek, które nazwali atomami (z greckiego "atomos" niepodzielny). Była to jednak bardziej hipoteza niż naukowo udowodniona teoria. Dopiero rozwój nauki i eksperymenty, zwłaszcza te z przełomu XIX i XX wieku, pozwoliły nam zajrzeć głębiej i odkryć, że atom wcale nie jest niepodzielny, lecz stanowi złożony układ mniejszych cząstek. To była prawdziwa rewolucja w myśleniu o materii!
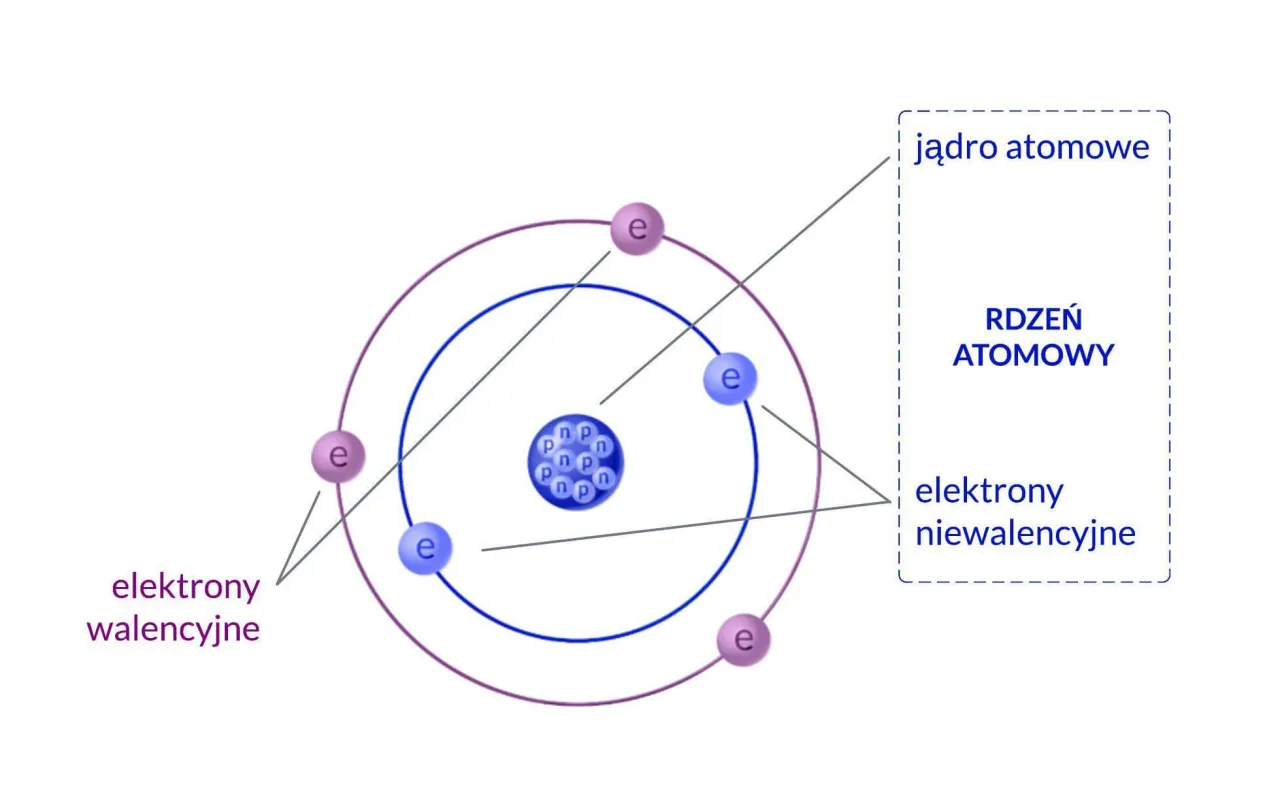
Zajrzyjmy do wnętrza atomu: poznaj jego kluczowe składniki
Skoro wiemy już, że atom to nie prosta, jednorodna kula, czas przyjrzeć się jego wewnętrznej strukturze. To właśnie tutaj zaczyna się prawdziwa magia i złożoność mikroświata.
Jądro atomowe: małe centrum o ogromnej masie
W samym sercu każdego atomu znajduje się jądro atomowe niezwykle gęste i dodatnio naładowane centrum. To właśnie w jądrze skupiona jest niemal cała masa atomu, ponad 99,9%! Można powiedzieć, że jądro to prawdziwy "ciężarowiec" atomu, mimo swoich mikroskopijnych rozmiarów. Jest ono zbudowane z cząstek, które zbiorczo nazywamy nukleonami.Protony i neutrony: co decyduje o tożsamości pierwiastka?
W skład jądra wchodzą dwa typy nukleonów: protony i neutrony. Protony to cząstki posiadające ładunek dodatni, a ich liczba w jądrze jest kluczowa to ona decyduje o tożsamości chemicznej pierwiastka. Na przykład, każdy atom z sześcioma protonami to węgiel. Neutrony natomiast są elektrycznie obojętne, ale mają masę zbliżoną do masy protonów, więc wpływają na całkowitą masę atomu. Co ciekawe, zarówno protony, jak i neutrony nie są cząstkami elementarnymi; składają się z jeszcze mniejszych jednostek zwanych kwarkami. Jedynym wyjątkiem od reguły posiadania zarówno protonów, jak i neutronów w jądrze jest najpowszechniejszy izotop wodoru, zwany protem, którego jądro składa się wyłącznie z jednego protonu.Chmura elektronowa: tajemniczy obszar wokół jądra
Wokół dodatnio naładowanego jądra krążą ujemnie naładowane elektrony, tworząc tak zwaną chmurę elektronową. W atomie, który jest elektrycznie obojętny, liczba elektronów jest zawsze równa liczbie protonów w jądrze. To bardzo ważne dla zachowania równowagi ładunków. Co istotne, chmura elektronowa nie ma wyraźnej, stałej granicy. Elektrony nie poruszają się po sztywnych, planetarnych orbitach, jak to często wyobrażamy sobie na uproszczonych schematach. Zamiast tego, ich położenie jest opisywane probabilistycznie jako obszary, w których istnieje największe prawdopodobieństwo ich znalezienia. To właśnie ta chmura nadaje atomowi jego rozmiar i odpowiada za większość jego objętości.
Niewyobrażalna skala: prawdziwe proporcje atomu
Kiedy mówimy o atomach, musimy przygotować się na liczby, które wykraczają poza naszą codzienną intuicję. Skala jest po prostu oszałamiająca.
Gdyby atom był stadionem: wizualizacja, która zmienia perspektywę
Aby naprawdę zrozumieć proporcje atomu, często używam pewnej analogii. Wyobraźmy sobie, że powiększamy jądro atomowe do rozmiaru małej monety, leżącej na środku boiska. W takim przypadku cały atom, czyli obszar, w którym poruszają się elektrony, miałby wielkość całego stadionu sportowego! To pokazuje, jak niewiarygodnie małe jest jądro w stosunku do reszty atomu. Ta wizualizacja doskonale ilustruje, że atom to w dużej mierze pusta przestrzeń, a jego masa jest skoncentrowana w maleńkim centrum.
Liczby, które robią wrażenie: rozmiary i masa w mikroświecie
Przejdźmy do konkretów. Typowy atom ma średnicę rzędu około 10-10 metra. Jądro atomowe jest jeszcze mniejsze jego średnica to zaledwie około 10-15 do 10-14 metra. Oznacza to, że średnica atomu jest od 10 000 do 100 000 razy większa od średnicy jądra! To tak, jakby porównać ziarnko piasku do całej kuli ziemskiej. Jak już wspomniałem, niemal cała masa atomu, ponad 99,9%, jest skoncentrowana w tym mikroskopijnym jądrze. Elektrony, choć nadają atomowi rozmiar, są niewiarygodnie lekkie masa pojedynczego elektronu jest około 1836 razy mniejsza niż masa protonu.
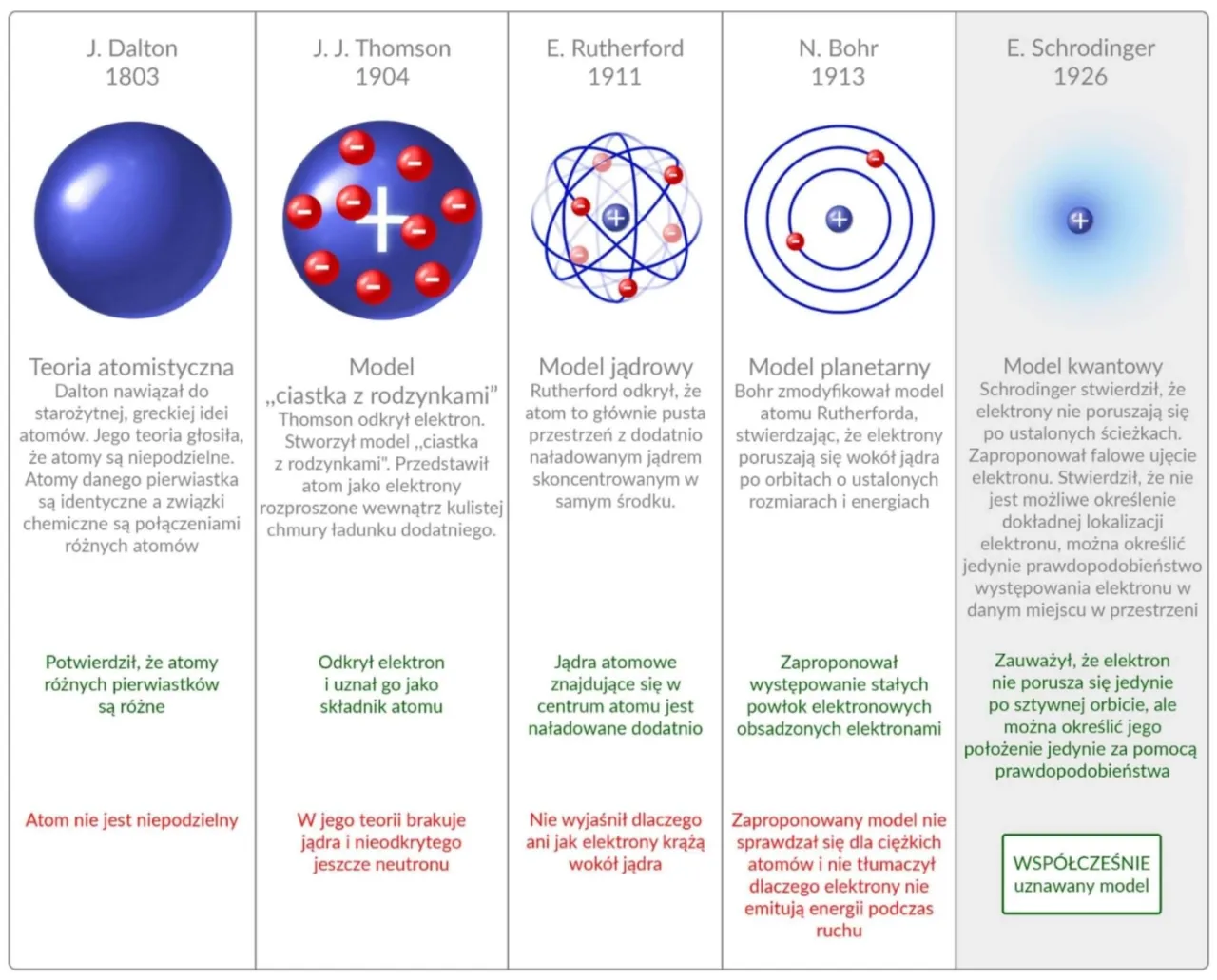
Ewolucja modeli atomu: od Układu Słonecznego do chmur prawdopodobieństwa
Nasze rozumienie "wyglądu" atomu nie pojawiło się z dnia na dzień. To wynik stuleci badań, eksperymentów i nieustannego kwestionowania poprzednich teorii. Przyjrzyjmy się kluczowym modelom, które ukształtowały naszą obecną wiedzę.
Model planetarny Rutherforda: przełom, który miał swoje wady
Na początku XX wieku Ernest Rutherford, na podstawie słynnego eksperymentu z rozpraszaniem cząstek alfa, zaproponował planetarny model atomu. Zakładał on, że atom składa się z bardzo małego, dodatnio naładowanego i ciężkiego jądra, wokół którego krążą ujemnie naładowane elektrony, niczym planety wokół Słońca. Był to ogromny przełom, który obalił wcześniejsze koncepcje, takie jak model "ciasta z rodzynkami" Thomsona. Jednak model Rutherforda miał poważne wady: zgodnie z prawami fizyki klasycznej, krążące elektrony powinny tracić energię i w końcu spaść na jądro, co oznaczałoby, że atomy są niestabilne. A przecież wiemy, że tak nie jest!
Model Bohra: orbity, powłoki i kwantowe przeskoki elektronów
Niels Bohr, próbując rozwiązać problemy modelu Rutherforda, wprowadził do fizyki kwantowej rewolucyjne założenia. W jego modelu, elektrony krążą po ściśle określonych, stacjonarnych orbitach (nazywanych powłokami energetycznymi) i nie tracą na nich energii. Dopiero gdy elektron przeskakuje z jednej orbity na drugą, emituje lub absorbuje kwant energii w postaci światła. To były tak zwane kwantowe przeskoki. Model Bohra, choć nadal uproszczony i mający swoje ograniczenia (np. nie radził sobie dobrze z atomami wieloelektronowymi), doskonale wyjaśniał stabilność atomu wodoru i jego widmo emisyjne. To był kolejny krok w kierunku zrozumienia kwantowej natury materii.
Współczesny model kwantowy: od orbit do chmur prawdopodobieństwa
Obecnie posługujemy się kwantowo-mechanicznym modelem atomu, który jest znacznie bardziej złożony i precyzyjny. Zastępuje on pojęcie sztywnych orbit Bohra koncepcją orbitali. Orbital to nie ścieżka, po której porusza się elektron, lecz trójwymiarowy obszar w przestrzeni wokół jądra, w którym istnieje największe prawdopodobieństwo znalezienia elektronu. Elektrony w tym modelu nie są już traktowane jako małe kuleczki krążące po określonych torach, ale jako fale prawdopodobieństwa. To sprawia, że "wygląd" atomu staje się bardziej abstrakcyjny to raczej rozmyta chmura prawdopodobieństwa niż precyzyjny układ planetarny.
Co sprawia, że atomy się różnią? Kluczowe pojęcia
Mimo że wszystkie atomy mają podobną budowę, to właśnie drobne różnice w ich składzie decydują o tym, jakimi pierwiastkami są i jak się zachowują. Poznajmy podstawowe pojęcia, które to wyjaśniają.
Liczba atomowa i masowa: dowód osobisty pierwiastka
Każdy pierwiastek ma swój unikalny "dowód osobisty". Jest nim liczba atomowa (Z), która określa liczbę protonów w jądrze atomu. To właśnie liczba protonów jest cechą definiującą dany pierwiastek. Na przykład, wszystkie atomy z Z=1 to wodór, a z Z=8 to tlen. Drugim ważnym pojęciem jest liczba masowa (A), która stanowi sumę protonów i neutronów w jądrze. Określa ona w przybliżeniu masę atomu.
Izotopy: kiedy ten sam pierwiastek występuje w różnych wersjach
Co ciekawe, atomy tego samego pierwiastka mogą różnić się liczbą neutronów. Takie odmiany nazywamy izotopami. Mają one tę samą liczbę protonów (czyli tę samą liczbę atomową Z), ale różną liczbę neutronów (a co za tym idzie, różną liczbę masową A). Najlepszym przykładem są izotopy wodoru:
- Prot (1H) ma jeden proton i zero neutronów.
- Deuter (2H) ma jeden proton i jeden neutron.
- Tryt (3H) ma jeden proton i dwa neutrony.
Jony: atomy, które zyskały lub straciły elektrony
Atomy w swoim naturalnym stanie są elektrycznie obojętne, ponieważ liczba dodatnich protonów jest równa liczbie ujemnych elektronów. Jednak atomy mogą zyskać lub stracić elektrony. Wtedy przestają być obojętne i stają się jonami, czyli cząstkami posiadającymi ładunek elektryczny. Jeśli atom straci elektron, staje się jonem dodatnim (kationem). Jeśli zyska elektron, staje się jonem ujemnym (anionem). To właśnie tworzenie jonów jest kluczowe w wielu reakcjach chemicznych i powstawaniu wiązań jonowych.
Dlaczego zrozumienie budowy atomu jest tak ważne?
Można by pomyśleć, że tak abstrakcyjna wiedza o niewidzialnych cząstkach ma znaczenie tylko dla garstki naukowców. Nic bardziej mylnego! Zrozumienie budowy atomu ma kolosalne znaczenie dla całej współczesnej nauki i technologii.
Od właściwości materiałów po energię jądrową
Wiedza o tym, jak zbudowane są atomy i jak oddziałują ze sobą elektrony, pozwala nam wyjaśniać właściwości materiałów dlaczego niektóre są twarde, inne elastyczne, a jeszcze inne przewodzą prąd. Jest to fundament dla rozwoju nowych materiałów o pożądanych cechach. To także podstawa dla zrozumienia wszystkich procesów chemicznych, od trawienia pokarmu po produkcję leków. Co więcej, manipulując jądrami atomowymi, możemy uzyskiwać ogromne ilości energii, co jest podstawą energii jądrowej, a także technologii medycznych, takich jak radioterapia czy diagnostyka obrazowa. Bez tej wiedzy, nasz świat wyglądałby zupełnie inaczej.Przeczytaj również: Kiedy atom jest elektrycznie obojętny? Klucz do zrozumienia chemii
Polski wkład w wizualizację atomu: sukces dr Anety Stodólnej
Warto wspomnieć, że w 2013 roku świat obiegła niezwykła wiadomość, a w jej centrum znalazła się polska fizyk, dr Aneta Stodólna. Kierowała ona zespołem naukowców z Holandii, który dokonał czegoś, co wcześniej wydawało się niemożliwe: wykonał pierwsze w historii zdjęcie obrazujące rozkład elektronów wewnątrz atomu wodoru. To nie było zdjęcie w tradycyjnym sensie, ale wizualizacja funkcji falowej elektronu, potwierdzająca kwantowo-mechaniczny model atomu. To osiągnięcie nie tylko jest powodem do dumy dla polskiej nauki, ale także stanowi namacalny dowód na to, jak daleko zaszliśmy w naszym dążeniu do zrozumienia, jak naprawdę wygląda atom.