Stworzenie efektownego modelu atomu na lekcję chemii czy fizyki to świetny sposób, by nie tylko zrozumieć podstawy budowy materii, ale także zdobyć wysoką ocenę. W tym artykule pokażę Ci, jak krok po kroku, z łatwo dostępnych materiałów, wykonać model, który z pewnością zrobi wrażenie na nauczycielu. Przygotuj się na dawkę praktycznych pomysłów i sprawdzonych instrukcji!
Model atomu na szóstkę: proste pomysły i materiały do stworzenia projektu
- Wykorzystaj łatwo dostępne materiały takie jak plastelina, kulki styropianowe czy druciki, aby zbudować model.
- Skup się na modelu przestrzennym (3D), który najlepiej oddaje strukturę atomu dla celów szkolnych.
- Przed rozpoczęciem sprawdź w układzie okresowym liczbę protonów, neutronów i elektronów dla wybranego pierwiastka.
- Pamiętaj o prawidłowym rozmieszczeniu elektronów na powłokach, bazując na uproszczonym modelu Bohra.
- Unikaj typowych błędów, takich jak nieprawidłowa liczba cząstek czy niestabilna konstrukcja.
Zanim zaczniesz: Szybkie przypomnienie budowy atomu
Zanim zabierzemy się do pracy, warto sobie przypomnieć, z czego właściwie składa się atom. W jego centrum znajduje się jądro atomowe, które jest niezwykle małe, ale za to bardzo gęste. W jądrze znajdziemy dwa typy cząstek: protony i neutrony. Wokół jądra, na tak zwanych powłokach elektronowych, krążą elektrony. Dla celów szkolnych najczęściej posługujemy się uproszczonym modelem Bohra, który przedstawia elektrony krążące po stałych, kołowych orbitach. Ten model jest idealny do wizualizacji i budowy fizycznego modelu.
- Protony (p+): Cząstki o ładunku dodatnim, znajdujące się w jądrze. Ich liczba decyduje o tym, jaki to pierwiastek.
- Neutrony (n0): Cząstki obojętne elektrycznie (bez ładunku), również znajdujące się w jądrze. Stabilizują jądro.
- Elektrony (e-): Cząstki o ładunku ujemnym, krążące wokół jądra na powłokach elektronowych. Ich liczba w neutralnym atomie jest równa liczbie protonów.
Czego będziesz potrzebować? Lista niezbędnych materiałów
Jedną z najlepszych rzeczy przy tworzeniu modelu atomu jest to, że nie potrzebujesz drogich ani trudno dostępnych materiałów. Często wszystko, co niezbędne, znajdziesz w domu lub kupisz za grosze w papierniczym. Oto lista moich ulubionych propozycji:
- Plastelina lub modelina: Idealna do formowania protonów, neutronów i elektronów. Różne kolory to podstawa!
- Kulki styropianowe: Dostępne w różnych rozmiarach, świetnie nadają się na jądro i elektrony w większych modelach.
- Koraliki lub pompony: Mogą posłużyć jako elektrony, dodając modelowi estetyki.
- Druciki kreatywne (chenille stems) lub florystyczne: Niezastąpione do tworzenia powłok elektronowych i łączenia elementów.
- Wykałaczki lub patyczki do szaszłyków: Przydatne do łączenia plastelinowych kulek w jądro i mocowania powłok.
- Klej (np. na gorąco, uniwersalny): Do trwałego łączenia styropianowych elementów.
- Karton lub kawałek sklejki: Może posłużyć jako stabilna podstawa dla Twojego modelu.
- Farby akrylowe, markery: Do malowania kulek styropianowych i opisywania elementów.
Klasyczny model atomu z plasteliny i wykałaczek idealny na start
Zacznijmy od metody, która jest prosta, tania i pozwala na szybkie stworzenie czytelnego modelu. Model z plasteliny i wykałaczek to klasyka, którą z powodzeniem wykonasz w domu. Sam często polecam ją moim uczniom jako pierwszy projekt.
Krok 1: Jak przygotować jądro atomowe?
Jądro atomowe to serce Twojego modelu. Aby je stworzyć, wybierz dwa kolory plasteliny jeden na protony, drugi na neutrony. Uformuj z nich odpowiednią liczbę kulek (pamiętaj, aby sprawdzić, ile protonów i neutronów ma Twój wybrany pierwiastek!). Następnie połącz je ze sobą, ściskając delikatnie lub używając krótkich kawałków wykałaczek, aby jądro było stabilne i zwarte. Staraj się, aby kulki były w miarę równej wielkości protony i neutrony są do siebie podobne pod względem masy.Krok 2: Tworzenie powłok elektronowych i rozmieszczanie elektronów
Teraz czas na elektrony i ich powłoki. Z cienkich drucików kreatywnych lub wykałaczek stwórz okręgi symbolizujące powłoki elektronowe. Możesz użyć różnych długości drucików, aby powłoki były w różnych odległościach od jądra. Następnie, z trzeciego koloru plasteliny, uformuj małe kulki to będą Twoje elektrony. Umieść je na przygotowanych powłokach, pamiętając o prawidłowym rozmieszczeniu (np. 2 elektrony na pierwszej powłoce, 8 na drugiej itd., zgodnie z modelem Bohra). Możesz przykleić je do drucików lub delikatnie wbić w wykałaczki.Krok 3: Łączenie elementów w stabilną konstrukcję
Stabilność to klucz do sukcesu, zwłaszcza gdy model ma przetrwać transport do szkoły. Aby połączyć jądro z powłokami, możesz użyć dłuższych wykałaczek, wbijając je w jądro i mocując do nich druciane powłoki. Jeśli model ma być większy, rozważ użycie kawałka kartonu lub styropianu jako podstawy. Po prostu wbij w nią wykałaczki z jądrem i powłokami, co zapewni całej konstrukcji solidne oparcie. Pamiętaj, aby wszystko było dobrze spasowane i nie chwiało się.

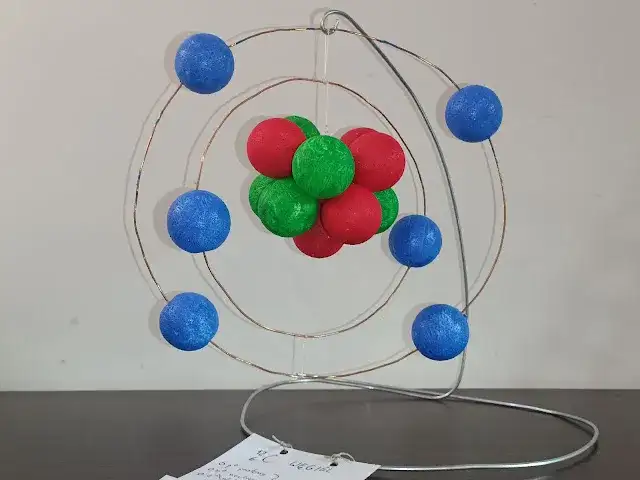
Efektowny model 3D z kulek styropianowych i drutu
Jeśli masz ochotę na coś bardziej zaawansowanego i trwałego, model z kulek styropianowych i drutu będzie strzałem w dziesiątkę. Taki przestrzenny model prezentuje się bardzo profesjonalnie i pozwala lepiej zrozumieć trójwymiarową naturę atomu. Sam często podziwiam kreatywność uczniów, którzy decydują się na takie rozwiązanie.
Dobór materiałów: Jakie kulki i druty sprawdzą się najlepiej?
Do jądra wybierz większą kulkę styropianową, która będzie stanowić bazę. Na protony i neutrony możesz użyć mniejszych kulek styropianowych (np. o średnicy 2-3 cm). Elektrony najlepiej przedstawić jeszcze mniejszymi kulkami (np. 1 cm). Jeśli chodzi o drut, polecam drut florystyczny lub kreatywny jest giętki, ale jednocześnie wystarczająco sztywny, by utrzymać kształt orbit. Grubość drutu dobierz tak, aby był proporcjonalny do rozmiaru kulek.
Instrukcja krok po kroku: Budowa przestrzennego modelu atomu
- Przygotowanie jądra: Weź większą kulkę styropianową jako bazę jądra. Mniejsze kulki styropianowe pomaluj na dwa różne kolory (np. czerwony dla protonów, niebieski dla neutronów). Po wyschnięciu farby, przyklej je do bazowej kulki, tworząc zwarte jądro. Możesz użyć kleju na gorąco, który szybko schnie i mocno trzyma.
- Formowanie orbit z drutu: Z drutu uformuj okręgi, które będą symbolizować powłoki elektronowe. Pamiętaj, aby każda kolejna powłoka była większa od poprzedniej. Końce drutu możesz skręcić lub skleić, aby okręgi były stabilne.
- Mocowanie elektronów na orbitach: Pomaluj najmniejsze kulki styropianowe na kolor symbolizujący elektrony (np. zielony). Po wyschnięciu, użyj krótkich kawał drutu lub kleju, aby przymocować elektrony do orbit. Upewnij się, że rozmieszczenie elektronów na powłokach jest zgodne z zasadami modelu Bohra.
- Łączenie jądra z orbitami: Aby połączyć jądro z orbitami, możesz użyć dłuższych kawałków drutu, wbijając je w jądro i mocując do nich poszczególne orbity. Staraj się, aby orbity były rozmieszczone w różnych płaszczyznach, co nada modelowi trójwymiarowego charakteru. Całość możesz osadzić na stabilnej podstawie.
Porada eksperta: Jak pomalować i oznaczyć elementy, by model był czytelny?
Czytelność to podstawa, zwłaszcza gdy nauczyciel ocenia Twój projekt. Zawsze radzę, aby protony, neutrony i elektrony miały wyraźnie różne kolory. Na przykład, czerwone protony, niebieskie neutrony i zielone elektrony. Po pomalowaniu kulek styropianowych możesz dodatkowo opisać je cienkim markerem (p+, n0, e-), aby nie było żadnych wątpliwości. Dobrym pomysłem jest również dołączenie małej legendy do modelu, która wyjaśni, co symbolizuje każdy kolor i element. To pokazuje dbałość o szczegóły i profesjonalne podejście.
Kreatywne i ekologiczne modele atomu zaskocz nauczyciela!
Chcesz wyróżnić się z tłumu i pokazać, że masz głowę pełną pomysłów? Kreatywność w projekcie szkolnym zawsze jest w cenie! Pamiętam, jak jeden z moich uczniów zrobił model atomu z... warzyw. Był to jeden z najbardziej oryginalnych projektów, jakie widziałem!
Jak wykorzystać materiały z recyklingu do budowy modelu?
Ekologiczne podejście to coś, co zyskuje na znaczeniu. Wykorzystanie materiałów z recyklingu nie tylko jest przyjazne dla środowiska, ale także pozwala stworzyć unikalny model. Oto kilka pomysłów:
- Nakrętki od butelek: Pomalowane na różne kolory, mogą świetnie udawać protony, neutrony i elektrony.
- Guziki: Podobnie jak nakrętki, guziki w różnych rozmiarach i kolorach mogą posłużyć jako cząstki elementarne.
- Kawałki kartonu lub tektury: Możesz wyciąć z nich okręgi na powłoki elektronowe lub użyć jako podstawy.
- Stare płyty CD: Mogą posłużyć jako błyszczące, futurystyczne orbity.
- Kulki z gazety lub papieru: Zgniecione i pomalowane, mogą zastąpić kulki styropianowe.
Słodki model atomu, czyli owoce i słodycze w roli cząstek elementarnych
Kto by pomyślał, że nauka może być tak smaczna? Jadalny model atomu to hit, który z pewnością zaskoczy każdego nauczyciela. Możesz wykorzystać:
- Winogrona, borówki, jarzębina: Idealne na protony, neutrony i elektrony ze względu na swój kulisty kształt i różnorodność kolorów.
- Żelki, pianki marshmallow: Można je łatwo nadziewać na wykałaczki, tworząc jądro i elektrony.
- Patyczki do szaszłyków: Posłużą jako łączniki między owocami lub słodyczami.
Pamiętaj tylko, żeby taki model przygotować tuż przed prezentacją, aby zachował świeżość!
Jak poprawnie odwzorować wybrany pierwiastek? Ściągawka dla ucznia
Klucz do sukcesu to nie tylko estetyka, ale przede wszystkim poprawność naukowa. Twój model musi wiernie odzwierciedlać strukturę wybranego pierwiastka. To właśnie tutaj wielu uczniów popełnia błędy, dlatego przygotowałem dla Ciebie krótką ściągawkę.
Gdzie znaleźć informacje? Korzystanie z układu okresowego
Układ okresowy pierwiastków to Twoja najlepsza przyjaciółka! Znajdziesz w nim wszystkie niezbędne informacje. Każdy pierwiastek ma swój symbol, a także dwie ważne liczby:- Liczba atomowa (Z): To ta mniejsza liczba, zazwyczaj umieszczona u góry symbolu pierwiastka. Liczba atomowa Z mówi Ci, ile protonów ma atom. W neutralnym atomie liczba elektronów jest zawsze równa liczbie protonów.
- Liczba masowa (A): To ta większa liczba, często zaokrąglona, umieszczona u dołu symbolu pierwiastka. Liczba masowa A to suma protonów i neutronów.
Aby obliczyć liczbę neutronów, wystarczy odjąć liczbę atomową od liczby masowej: Neutrony = A - Z.
Obliczanie liczby protonów, neutronów i elektronów na konkretnym przykładzie (np. atomu węgla)
Weźmy na przykład atom węgla (C). Sprawdźmy w układzie okresowym:
- Symbol: C
- Liczba atomowa (Z): 6
- Liczba masowa (A): 12 (zaokrąglona)
Teraz obliczmy:
- Protony: Z = 6. Atom węgla ma 6 protonów.
- Elektrony: W neutralnym atomie liczba elektronów = liczba protonów = 6. Atom węgla ma 6 elektronów.
- Neutrony: A - Z = 12 - 6 = 6. Atom węgla ma 6 neutronów.
Twój model atomu węgla powinien więc zawierać 6 protonów, 6 neutronów w jądrze i 6 elektronów krążących wokół niego.
Prawidłowe rozmieszczenie elektronów na powłokach klucz do sukcesu
Elektrony nie krążą wokół jądra w sposób chaotyczny. Rozmieszczają się na powłokach elektronowych według określonych zasad. W modelu Bohra wygląda to następująco:
- Pierwsza powłoka (najbliżej jądra): Maksymalnie 2 elektrony.
- Druga powłoka: Maksymalnie 8 elektronów.
- Trzecia powłoka: Maksymalnie 18 elektronów (choć dla prostych pierwiastków często wystarczy 8).
Zawsze wypełniamy powłoki od najbliższej jądru. Dla atomu węgla (6 elektronów) będzie to: 2 elektrony na pierwszej powłoce i 4 elektrony na drugiej powłoce. Pamiętaj o tym, projektując swój model, bo to kluczowy element jego poprawności.
Najczęstsze błędy przy tworzeniu modelu atomu i jak ich uniknąć
Nawet najlepsi popełniają błędy, ale sztuką jest uczyć się na nich i ich unikać. Jako Daniel Kowalski, widziałem już wiele modeli atomów i zebrałem listę najczęstszych potknięć, które łatwo możesz ominąć.
Błąd #1: Nieprawidłowa liczba cząstek w modelu
To chyba najczęstszy błąd uczniowie błędnie odczytują dane z układu okresowego lub mylą protony z neutronami. Skutkuje to modelem, który przedstawia inny pierwiastek niż zamierzony. Jak tego uniknąć? Zawsze, ale to zawsze, dwukrotnie sprawdź liczbę atomową (Z) i masową (A) wybranego pierwiastka. Zapisz sobie na kartce, ile ma być protonów, neutronów i elektronów, zanim zaczniesz formować kulki. To prosta czynność, która oszczędzi Ci mnóstwo pracy.
Błąd #2: Niestabilna lub nieczytelna konstrukcja
Model, który rozpada się w drodze do szkoły, albo taki, w którym trudno odróżnić protony od elektronów, nie spełni swojej roli. Jak tego uniknąć?
- Stabilność: Używaj mocnych łączników (wykałaczki, drut), a jeśli to możliwe, zamocuj model na stabilnej podstawie. Klej na gorąco jest Twoim sprzymierzeńcem przy łączeniu styropianowych elementów.
- Czytelność: Stosuj wyraźnie różne kolory dla protonów, neutronów i elektronów. Możesz nawet użyć markerów do opisania każdej cząstki. Pamiętaj o proporcjach jądro jest znacznie mniejsze niż cała przestrzeń, w której poruszają się elektrony.
Przeczytaj również: Czy można zobaczyć atom? Jak naukowcy "widzą" niewidzialne.
Błąd #3: Pomylenie pojęć model Bohra a rzeczywistość
Warto pamiętać, że model Bohra, na którym opierają się szkolne projekty, jest uproszczeniem. W rzeczywistości elektrony nie krążą po stałych, kołowych orbitach jak planety wokół Słońca. Współczesna fizyka kwantowa opisuje elektrony jako chmury prawdopodobieństwa (orbitale), co jest znacznie bardziej skomplikowane do wizualizacji. Jak tego uniknąć? Po prostu bądź świadomy, że Twój model jest narzędziem dydaktycznym, które pomaga zrozumieć podstawy. Nie musisz wdawać się w zawiłości mechaniki kwantowej, ale dobrze jest wiedzieć, że model Bohra to tylko jeden z etapów w rozwoju nauki o atomie. Do celów szkolnych jest jednak w pełni akceptowalny i bardzo przydatny.