Zastanawialiście się kiedyś, dlaczego atomy nie istnieją w izolacji, lecz łączą się ze sobą, tworząc wszystko, co nas otacza od wody po skomplikowane białka? Kluczem do zrozumienia tego fundamentalnego zjawiska jest ich nieustanne dążenie do osiągnięcia stabilności energetycznej. W tym artykule, jako Daniel Kowalski, postaram się w przystępny sposób wyjaśnić podstawowe zasady chemiczne rządzące tymi procesami, odkrywając niewidzialny świat atomowych połączeń.
Dlaczego atomy się łączą? Wprowadzenie do świata wiązań chemicznych
Fundamentalną przyczyną, dla której atomy łączą się ze sobą, jest ich dążenie do osiągnięcia stanu o niższej, bardziej stabilnej energii. Wyobraźcie sobie, że każdy atom jest jak mała kulka energii, która woli być w "zagłębieniu" niż na "szczycie" wzgórza. Tworzenie wiązań chemicznych jest dla nich korzystne energetycznie, co prowadzi do powstania trwałego połączenia i utworzenia cząsteczki lub związku chemicznego, które są stabilniejsze niż pojedyncze, wolne atomy.
Wiązanie chemiczne możemy zatem zdefiniować jako trwałe oddziaływanie między dwoma lub więcej atomami, które prowadzi do powstania stabilnej jednostki, takiej jak cząsteczka czy sieć krystaliczna. To właśnie te wiązania są odpowiedzialne za strukturę i właściwości całej materii, którą znamy.
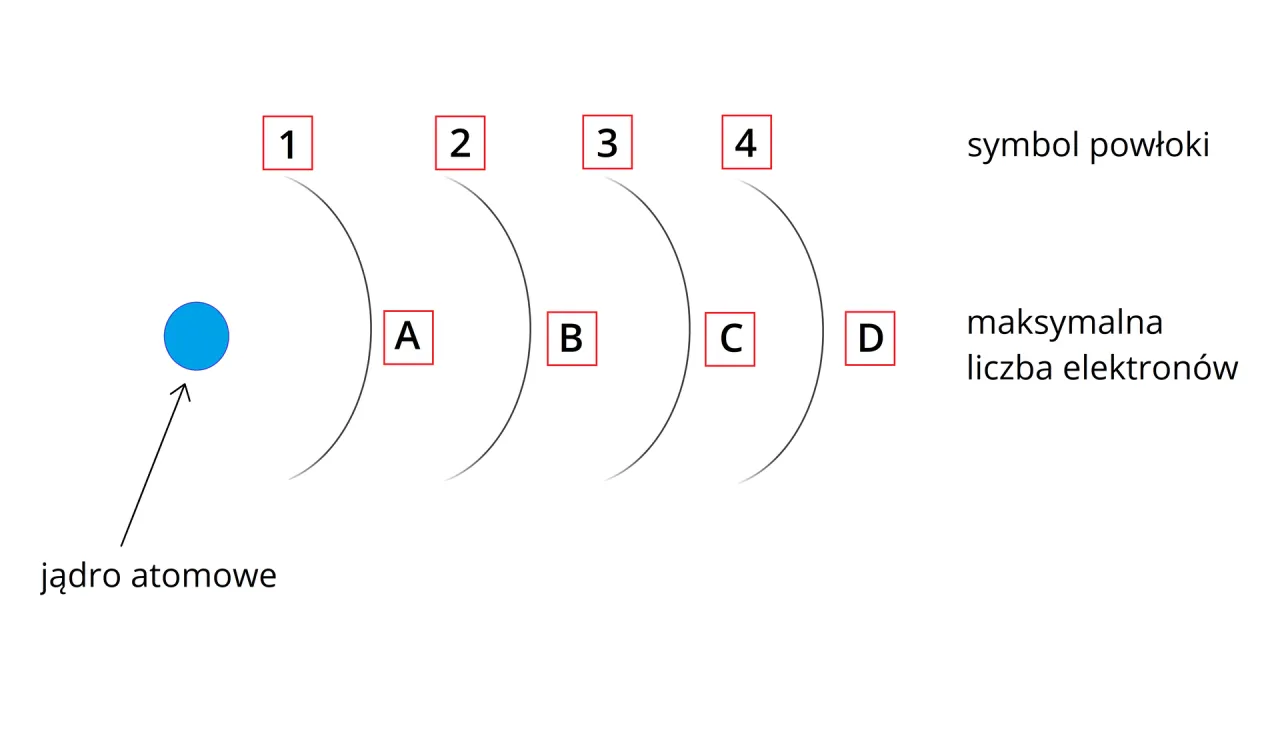
Elektrony walencyjne: Niewidzialni architekci wiązań
W procesie tworzenia wiązań chemicznych kluczową rolę odgrywają elektrony walencyjne. Są to elektrony znajdujące się na najbardziej zewnętrznej powłoce elektronowej atomu, czyli te najbardziej oddalone od jądra. To właśnie ich liczba i sposób, w jaki oddziałują z elektronami innych atomów, decydują o "charakterze" chemicznym atomu i jego zdolności do tworzenia wiązań. Można powiedzieć, że są to elektrony "kontaktowe", które faktycznie uczestniczą w "negocjacjach" z innymi atomami.- Oddawanie elektronów: Atomy o małej liczbie elektronów walencyjnych (zazwyczaj metale) często dążą do ich oddania, aby osiągnąć stabilną konfigurację elektronową.
- Przyjmowanie elektronów: Atomy o dużej liczbie elektronów walencyjnych (zazwyczaj niemetale) mają tendencję do ich przyjmowania, aby uzupełnić swoją zewnętrzną powłokę.
- Uwspólnianie elektronów: Wiele atomów, zwłaszcza niemetali, może również uwspólniać elektrony z innymi atomami, tworząc wspólne pary elektronowe, które należą do obu atomów jednocześnie.
Reguła oktetu i dubletu: Złota zasada stabilności atomów
Główną zasadą, która rządzi tworzeniem wiązań chemicznych, jest dążenie atomów do uzyskania konfiguracji elektronowej najbliższego im gazu szlachetnego (helowca). Gazy szlachetne, takie jak neon czy argon, są niezwykle stabilne i mało reaktywne, ponieważ ich zewnętrzna powłoka elektronowa jest całkowicie zapełniona. Atomy innych pierwiastków "naśladują" tę stabilność poprzez tworzenie wiązań. Realizacja tej reguły zapewnia atomom największą stabilność.
- Reguła oktetu: Większość atomów dąży do posiadania ośmiu elektronów na swojej powłoce walencyjnej. Jest to najczęstsza droga do osiągnięcia stabilności, na przykład atomy tlenu czy chloru dążą do utworzenia oktetu.
- Reguła dubletu: W przypadku najlżejszych atomów, takich jak wodór i hel, reguła ta jest nieco inna. Dążą one do posiadania dwóch elektronów na powłoce walencyjnej, co odpowiada konfiguracji elektronowej helu.
Elektroujemność: Jak rozpoznać typ atomowej relacji?
Elektroujemność to miara zdolności atomu do przyciągania elektronów w wiązaniu chemicznym. Jest to niezwykle ważna właściwość, ponieważ to właśnie różnica elektroujemności (ΔE) między łączącymi się atomami decyduje o typie powstałego wiązania. Im większa różnica, tym silniej jeden atom "ciągnie" elektrony do siebie. Skala Paulinga jest najpopularniejszym sposobem mierzenia tej siły, przypisując wartości liczbowe poszczególnym pierwiastkom.
| Zakres różnicy elektroujemności (ΔE) | Rodzaj wiązania |
|---|---|
| ΔE < 0,4 | Wiązanie kowalencyjne niespolaryzowane |
| 0,4 ≤ ΔE ≤ 1,7 | Wiązanie kowalencyjne spolaryzowane |
| ΔE > 1,7 | Wiązanie jonowe |
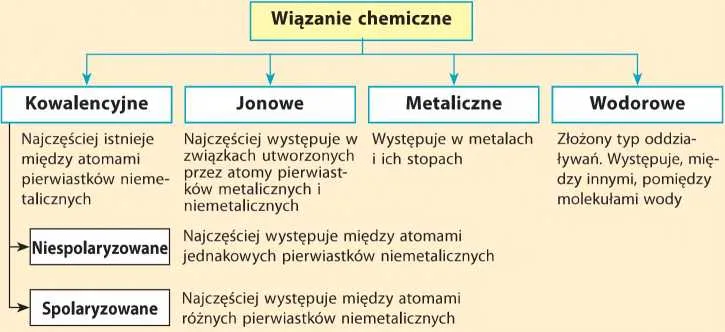
Główne typy wiązań chemicznych: Atomowe układy
Wiązanie kowalencyjne: Sprawiedliwy podział czy przeciąganie liny?
Wiązanie kowalencyjne, często nazywane atomowym, powstaje w wyniku uwspólnienia jednej lub więcej par elektronów między atomami. Jest to typ wiązania charakterystyczny dla niemetali. Elektrony te krążą wokół obu jąder atomowych, tworząc wspólną chmurę elektronową, która spaja atomy.
Jeśli atomy mają bardzo podobną lub identyczną elektroujemność, elektrony są rozłożone równomiernie mówimy wtedy o wiązaniu kowalencyjnym niespolaryzowanym. Doskonałym przykładem jest cząsteczka tlenu (O₂), gdzie dwa atomy tlenu dzielą elektrony po równo.
Kiedy jednak jeden z atomów jest nieco bardziej elektroujemny niż drugi, uwspólnione elektrony są przesunięte w jego stronę, tworząc biegunowość to jest wiązanie kowalencyjne spolaryzowane. Klasycznym przykładem jest woda (H₂O), gdzie elektrony są silniej przyciągane przez atom tlenu niż wodoru, co nadaje cząsteczce charakter dipolowy.
Wiązanie jonowe: Radykalny transfer, czyli kto zyskuje, a kto traci?
Wiązanie jonowe powstaje, gdy różnica elektroujemności między atomami jest bardzo duża. W takim przypadku dochodzi do całkowitego transferu elektronów z jednego atomu na drugi. Atom, który oddaje elektron(y), staje się dodatnio naładowanym jonem kationem. Atom, który przyjmuje elektron(y), staje się ujemnie naładowanym jonem anionem. Te przeciwnie naładowane jony silnie się przyciągają siłami elektrostatycznymi, tworząc wiązanie jonowe.
Najlepszym przykładem jest chlorek sodu (NaCl), czyli sól kuchenna. Atom sodu (metal) oddaje jeden elektron atomowi chloru (niemetal). W efekcie powstaje dodatni jon sodu (Na⁺) i ujemny jon chloru (Cl⁻), które są ze sobą silnie związane, tworząc kryształ soli.
Przeczytaj również: Jak zbudować model atomu? Przewodnik DIY krok po kroku!
Wiązanie metaliczne: Wspólnota i swoboda w morzu elektronów
Wiązanie metaliczne jest unikalnym typem wiązania, charakterystycznym dla metali i ich stopów. Polega ono na oddziaływaniu dodatnio naładowanych jąder atomowych (kationów metali) z "morzem" swobodnie poruszających się, zdelokalizowanych elektronów walencyjnych. Elektrony te nie są związane z konkretnym atomem, lecz poruszają się po całej strukturze metalu.
Ta specyficzna struktura elektronowa jest odpowiedzialna za charakterystyczne właściwości metali, takie jak ich doskonałe przewodnictwo elektryczne i cieplne (dzięki ruchomym elektronom), a także ich połysk i kowalność. To właśnie to "morze elektronów" spaja atomy metali w jedną, spójną całość.
Słabsze oddziaływania: Wiązania wodorowe i siły van der Waalsa
Oprócz silnych wiązań chemicznych, które omówiliśmy, istnieją również słabsze oddziaływania międzycząsteczkowe. Mimo że są znacznie słabsze, odgrywają niezwykle istotną rolę w kształtowaniu właściwości materii, a także w procesach biologicznych, takich jak zwijanie białek czy struktura DNA.
Wiązania wodorowe to specjalny typ oddziaływania, który występuje między cząsteczkami zawierającymi wodór połączony z silnie elektroujemnym atomem (np. tlenem, azotem, fluorem). Są one odpowiedzialne za wiele niezwykłych właściwości wody, takich jak jej wysoka temperatura wrzenia czy napięcie powierzchniowe.
Siły van der Waalsa to ogólna nazwa dla różnych słabych oddziaływań międzycząsteczkowych, które wynikają z chwilowych wahań rozkładu elektronów w cząsteczkach. Są one obecne we wszystkich substancjach i choć pojedynczo są bardzo słabe, ich suma może mieć znaczący wpływ na właściwości fizyczne, takie jak temperatura topnienia i wrzenia.Energia wiązania: Jak silne są atomowe więzi?
Energia wiązania to kluczowa miara, która mówi nam o sile wiązania chemicznego. Definiuje się ją jako energię potrzebną do rozerwania jednego mola danego wiązania. Im wyższa energia wiązania, tym jest ono trwalsze i tym więcej energii trzeba dostarczyć, aby je zerwać. To właśnie energia wiązania decyduje o stabilności cząsteczek i o tym, ile energii jest uwalniane lub pochłaniane podczas reakcji chemicznych.

