Historia odkrywania atomu to jedna z najbardziej fascynujących podróży w dziejach nauki, rozciągająca się od starożytnych filozofów po współczesnych fizyków kwantowych. To opowieść o tym, jak ludzkość krok po kroku zgłębiała tajemnice materii, zmieniając nasze rozumienie wszechświata i otwierając drzwi do niewyobrażalnych technologii. Zapraszam do zgłębienia tej niezwykłej historii, która pokazuje, że nauka to ciągła ewolucja idei i odkryć.
Odkrycie atomu to długa podróż naukowa, a nie dzieło jednej osoby.
- Starożytni filozofowie, jak Demokryt, jako pierwsi wysnuli ideę niepodzielnych cząstek materii atomów.
- John Dalton na początku XIX wieku sformułował pierwszą naukową teorię atomistyczną, opartą na dowodach chemicznych.
- Joseph J. Thomson odkrył elektron, dowodząc, że atom nie jest niepodzielny.
- Ernest Rutherford, dzięki eksperymentowi ze złotą folią, odkrył jądro atomowe i zaproponował model planetarny.
- Niels Bohr udoskonalił model atomu, wprowadzając kwantowe orbity elektronów.
- James Chadwick odkrył neutron, dopełniając obraz podstawowych składników atomu.
- Współczesna wiedza opiera się na kwantowo-mechanicznym modelu, opisującym elektrony jako chmury prawdopodobieństwa.
Czym jest atom i dlaczego jego odkrycie zmieniło wszystko?
Atom to podstawowa jednostka materii, najmniejsza cząstka pierwiastka chemicznego, która zachowuje jego właściwości. Zrozumienie jego budowy i zachowania okazało się absolutnie fundamentalne dla rozwoju całej współczesnej nauki i technologii. To właśnie wiedza o atomie pozwoliła nam wyjaśnić, jak działają reakcje chemiczne, skąd bierze się energia gwiazd, jak budowane są materiały, a nawet jak funkcjonuje życie. Bez tej wiedzy nie byłoby ani chemii, ani fizyki jądrowej, ani elektroniki, ani nowoczesnej medycyny. To naprawdę jeden z tych kamieni milowych, które całkowicie przeformatowały nasze postrzeganie świata.
Starożytna intuicja: jak Demokryt wyprzedził swoją epokę?
Idea atomu, czyli greckiego *atomos* oznaczającego „niepodzielny”, narodziła się w umysłach starożytnych filozofów, Leucypa i jego ucznia Demokryta, około IV wieku p.n.e. Była to koncepcja niezwykle śmiała i rewolucyjna jak na tamte czasy. Demokryt postulował, że cała materia składa się z niezliczonych, wiecznych, niepodzielnych i niezmiennych cząstek, które różnią się kształtem, rozmiarem i ułożeniem. To właśnie te różnice miały odpowiadać za odmienne właściwości obserwowanych substancji. Musimy jednak pamiętać, że była to czysta intuicja, genialna spekulacja filozoficzna, która nie była poparta żadnymi dowodami doświadczalnymi. Mimo to, jak widać, niektóre idee potrafią przetrwać tysiąclecia, czekając na swoje naukowe potwierdzenie.

John Dalton: naukowe podstawy teorii atomu
Prawdziwy przełom w myśleniu o atomie nastąpił na początku XIX wieku, a jego autorem był angielski chemik i fizyk, John Dalton. To on, opierając się na obserwacjach chemicznych i prawach zachowania masy oraz stałych proporcji, sformułował pierwszą nowożytną, naukową teorię atomistyczną. Jego praca, datowana na lata 1803-1808, stanowiła absolutny fundament dla rozwoju współczesnej chemii, przenosząc ideę atomu z obszaru filozofii do empirycznej nauki.
Jakie były filary pierwszej naukowej teorii atomu?
- Cała materia składa się z atomów: Dalton postulował, że atomy są najmniejszymi, niepodzielnymi cząstkami materii, które nie mogą być ani tworzone, ani niszczone podczas reakcji chemicznych.
- Atomy tego samego pierwiastka są identyczne: Wszystkie atomy danego pierwiastka (np. tlenu) mają identyczną masę, rozmiar i właściwości chemiczne.
- Atomy różnych pierwiastków różnią się od siebie: Atomy różnych pierwiastków (np. tlenu i wodoru) mają odmienną masę i właściwości.
- Atomy łączą się w stałych proporcjach, tworząc związki chemiczne: Kiedy atomy różnych pierwiastków łączą się, tworzą cząsteczki związków chemicznych w prostych, całkowitych stosunkach liczbowych. Na przykład, woda zawsze składa się z dwóch atomów wodoru i jednego atomu tlenu.
- Reakcje chemiczne to przegrupowanie atomów: Podczas reakcji chemicznych atomy są jedynie przestawiane, łączone lub rozdzielane, ale same pozostają niezmienione.
Dlaczego model Daltona, choć niedoskonały, był rewolucją?
Model Daltona, choć z perspektywy dzisiejszej wiedzy wydaje się uproszczony i niedoskonały (wiemy przecież, że atomy nie są niepodzielne i istnieją izotopy), był absolutną rewolucją w nauce. Po raz pierwszy w historii teoria atomistyczna została oparta na empirycznych dowodach i obserwacjach chemicznych, a nie tylko na spekulacjach. Dzięki niemu chemicy zyskali narzędzie do systematyzowania wiedzy, przewidywania wyników reakcji i zrozumienia, dlaczego substancje reagują w określony sposób. To właśnie teoria Daltona otworzyła drogę do dalszych badań i weryfikacji, stając się punktem wyjścia dla wszystkich kolejnych odkryć dotyczących budowy atomu. Bez niej, jestem przekonany, rozwój chemii wyglądałby zupełnie inaczej.
Przełomowe odkrycia: atom ma swoje tajemnice
Przez dziesięciolecia teoria Daltona dominowała w nauce, ale w drugiej połowie XIX wieku zaczęły pojawiać się sygnały, że atom może wcale nie być taką prostą, niepodzielną kulką, jak wcześniej sądzono. Seria przełomowych odkryć na przełomie wieków całkowicie zmieniła nasze postrzeganie tej fundamentalnej jednostki materii, ujawniając jej złożoną i fascynującą wewnętrzną strukturę.
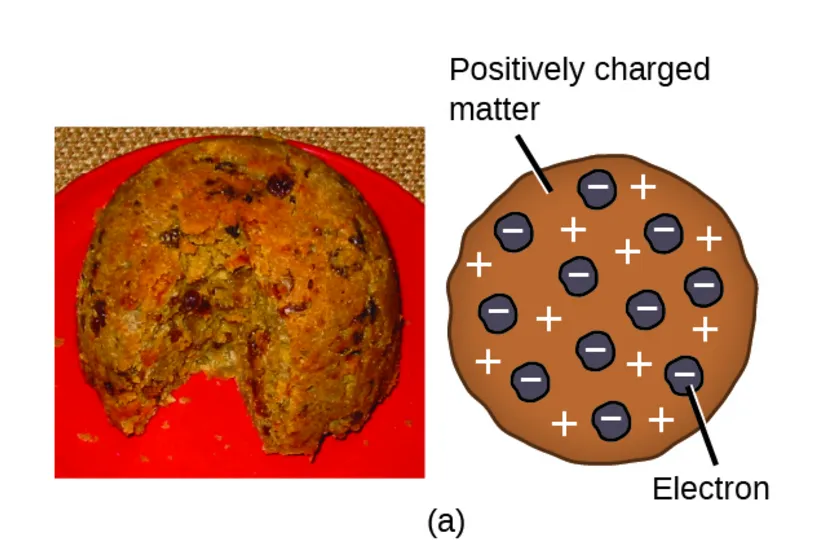
J. J. Thomson i "ciasto z rodzynkami": jak odkryto elektron?
Kluczowym momentem było odkrycie elektronu przez Josepha J. Thomsona w 1897 roku. Badając promienie katodowe strumienie cząstek emitowanych w rurach próżniowych Thomson wykazał, że składają się one z ujemnie naładowanych cząstek, które były znacznie lżejsze niż najlżejszy atom (wodoru). Nazwał je elektronami. To odkrycie było niczym trzęsienie ziemi w świecie nauki, ponieważ bezsprzecznie obaliło tezę o niepodzielności atomu. Skoro atom zawiera mniejsze od siebie cząstki, to musi mieć jakąś wewnętrzną strukturę! Thomson, aby wyjaśnić to zjawisko, zaproponował swój słynny model "ciasta z rodzynkami", w którym atom wyobrażał sobie jako dodatnio naładowaną kulę (ciasto), w której równomiernie rozmieszczone są ujemne elektrony (rodzynki), neutralizując ładunek i zapewniając stabilność.
Rola Marii Skłodowskiej-Curie: co promieniotwórczość ujawniła o wnętrzu atomu?
W tym samym okresie, gdy Thomson odkrywał elektron, inni naukowcy, w tym Henri Becquerel oraz Maria Skłodowska-Curie i Piotr Curie, prowadzili pionierskie badania nad zjawiskiem promieniotwórczości. Odkrycie, że niektóre pierwiastki, takie jak uran, a później polon i rad (odkryte przez Skłodowską-Curie), samorzutnie emitują promieniowanie, było kolejnym potężnym dowodem na to, że atom nie jest stabilną, niezmienną cząstką. Wręcz przeciwnie atomy te ulegały przemianom, emitując energię i cząstki, co jednoznacznie wskazywało na ich złożoną i dynamiczną budowę wewnętrzną. Prace Marii Skłodowskiej-Curie nie tylko otworzyły nową dziedzinę fizyki, ale także dostarczyły kluczowych poszlak, które pomogły naukowcom zrozumieć, że w sercu atomu dzieje się znacznie więcej, niż początkowo przypuszczano.
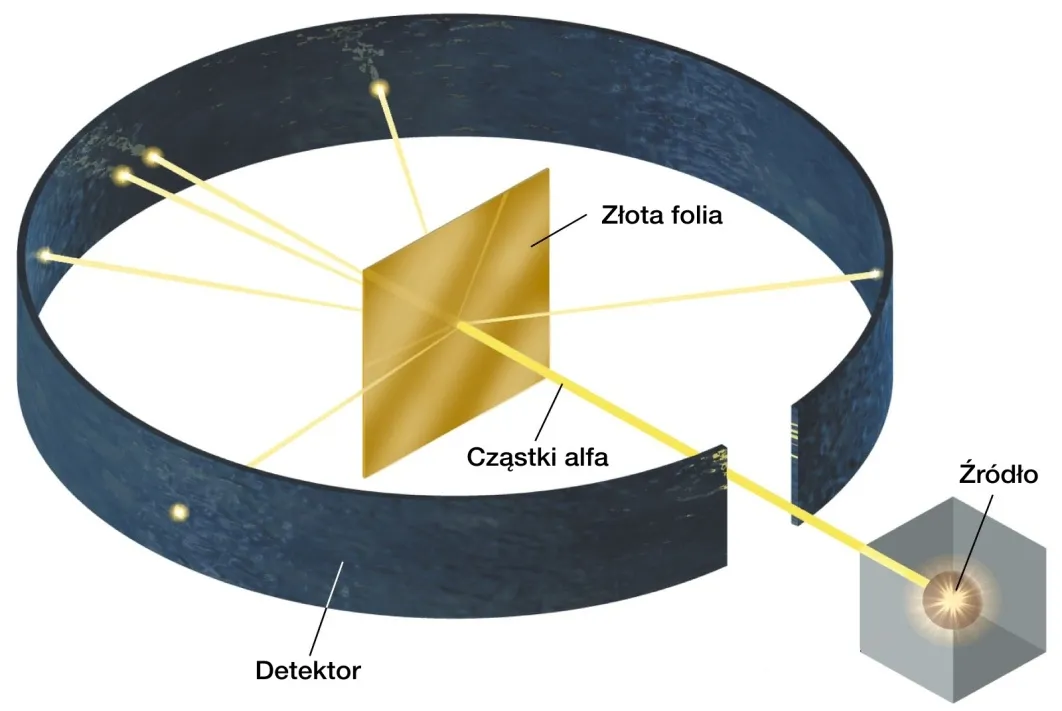
Ernest Rutherford zagląda do środka: narodziny jądra atomowego
Po odkryciu elektronu i zjawiska promieniotwórczości stało się jasne, że model "ciasta z rodzynkami" Thomsona nie jest ostatecznym rozwiązaniem. Prawdziwy przełom w zrozumieniu wewnętrznej struktury atomu nastąpił dzięki Ernestowi Rutherfordowi, nowozelandzkiemu fizykowi, który w 1911 roku przeprowadził jedno z najważniejszych doświadczeń w historii nauki.
Eksperyment ze złotą folią: jedno z najważniejszych doświadczeń w historii
Rutherford wraz ze swoimi współpracownikami, Hansem Geigerem i Ernestem Marsdenem, przeprowadził słynny eksperyment, w którym bombardowano bardzo cienką złotą folię dodatnio naładowanymi cząstkami alfa (jądrami helu). Zgodnie z modelem Thomsona, cząstki alfa powinny były przechodzić przez folię niemal bez odchylenia, ponieważ dodatni ładunek atomu miał być rozłożony równomiernie, a elektrony były zbyt lekkie, by znacząco wpłynąć na tor ciężkich cząstek alfa. Jednak obserwacje były zaskakujące i wręcz szokujące dla naukowców:
- Większość cząstek alfa przechodziła przez folię prosto, bez żadnego odchylenia.
- Niewielka część cząstek ulegała znacznemu odchyleniu od pierwotnego toru.
- Bardzo mała liczba cząstek (około 1 na 8000) odbijała się od folii pod dużym kątem, a nawet wracała w kierunku źródła!
Rutherford skomentował to, mówiąc, że było to tak niewiarygodne, jakby wystrzelić pocisk w kawałek bibułki, a on odbiłby się i uderzył strzelca. Te niespodziewane wyniki doprowadziły go do wniosku, że model Thomsona jest błędny.
Czym zaskoczył naukowców model planetarny atomu?
Na podstawie swojego eksperymentu Rutherford zaproponował nowy, rewolucyjny model atomu, znany jako model planetarny. Zgodnie z nim:
- Cały dodatni ładunek oraz niemal cała masa atomu są skupione w bardzo małym, gęstym obszarze w centrum, który nazwał jądrem atomowym.
- Elektrony krążą wokół tego jądra po orbitach, podobnie jak planety wokół Słońca.
- Większość objętości atomu to pusta przestrzeń.
Ten model całkowicie obalił koncepcję "ciasta z rodzynkami". Atom okazał się być w większości pustą przestrzenią, z maleńkim, ale niezwykle gęstym jądrem w centrum. To było odkrycie, które na zawsze zmieniło nasze rozumienie mikroświata i otworzyło drogę do fizyki jądrowej.
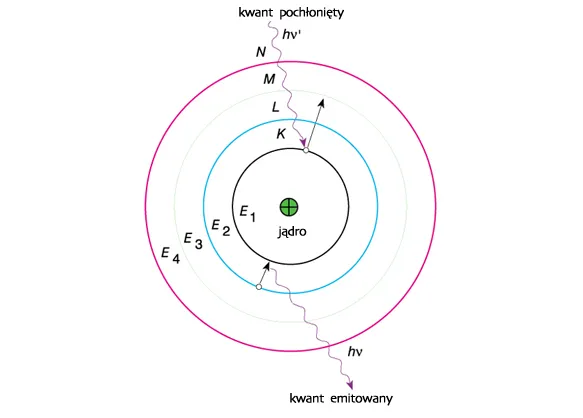
Od planetarnych orbit do kwantowej chmury: ewolucja modeli atomu
Model planetarny Rutherforda, choć przełomowy, miał swoje wady. Zgodnie z klasyczną fizyką, elektrony krążące wokół jądra powinny nieustannie tracić energię poprzez promieniowanie elektromagnetyczne i w końcu spaść na jądro, co doprowadziłoby do niestabilności atomu. A przecież atomy są stabilne! Ta sprzeczność wymagała dalszych udoskonaleń, które nadeszły wraz z narodzinami mechaniki kwantowej.
Niels Bohr porządkuje chaos: czym są stacjonarne orbity elektronowe?
W 1913 roku Niels Bohr, duński fizyk i współpracownik Rutherforda, zaproponował udoskonalenie modelu planetarnego, wprowadzając do niego elementy raczkującej wówczas mechaniki kwantowej. Jego model, znany jako model Bohra, postulował, że:
- Elektrony krążą wokół jądra tylko po ściśle określonych, stacjonarnych orbitach, na których nie emitują ani nie absorbują energii. Każda orbita odpowiada określonemu poziomowi energii.
- Elektron może przeskoczyć z jednej orbity na drugą tylko wtedy, gdy pochłonie lub wyemituje ściśle określoną porcję energii, czyli kwant energii. To wyjaśniało obserwowane widma emisyjne i absorpcyjne pierwiastków.
- Im dalej od jądra znajduje się orbita, tym wyższa jest energia elektronu na tej orbicie.
Model Bohra z sukcesem wyjaśnił stabilność atomów i widmo wodoru, ale miał ograniczenia nie radził sobie z atomami wieloelektronowymi i nie tłumaczył subtelnych szczegółów widm.
Ostatni element układanki: jak James Chadwick odkrył neutron?
Wiedza o atomie była już dość zaawansowana, ale brakowało jeszcze jednego kluczowego elementu. W 1932 roku James Chadwick, brytyjski fizyk, dokonał kolejnego fundamentalnego odkrycia neutronu. Badając promieniowanie powstające podczas bombardowania berylu cząstkami alfa, Chadwick wykazał istnienie nowej cząstki w jądrze atomowym, która miała masę zbliżoną do protonu, ale była pozbawiona ładunku elektrycznego. Odkrycie neutronu dopełniło obraz podstawowych składników atomu: jądro składa się z dodatnio naładowanych protonów i neutralnych neutronów, a wokół niego krążą ujemne elektrony. To właśnie ta wiedza otworzyła drogę do zrozumienia izotopów i reakcji jądrowych.
Czym jest orbital? Współczesny model kwantowo-mechaniczny w pigułce
Dzisiejsze rozumienie atomu znacznie wykracza poza proste orbity Bohra. Współczesny model, oparty na mechanice kwantowej (rozwiniętej m.in. przez Erwina Schrödingera w 1926 roku), jest znacznie bardziej złożony i precyzyjny. W tym modelu nie mówimy już o elektronach krążących po konkretnych orbitach, ale o orbitalach. Orbital to matematyczna funkcja opisująca obszar w przestrzeni wokół jądra, w którym istnieje największe prawdopodobieństwo znalezienia elektronu. Elektrony nie są już postrzegane jako małe kuleczki, ale jako obiekty o podwójnej naturze zarówno cząstki, jak i fale (dualizm korpuskularno-falowy). Ten kwantowo-mechaniczny model atomu, choć trudny do wizualizacji, jest niezwykle skuteczny w przewidywaniu zachowania atomów i leży u podstaw całej współczesnej chemii i fizyki materiałowej.Od jednej idei do technologii: podsumowanie wielkiego odkrycia
Patrząc na całą tę historię, od starożytnych filozofów po współczesnych fizyków, staje się jasne, że odkrycie atomu to nie jest dzieło jednej osoby, ani nawet jednego pokolenia. To raczej nieustający proces kumulowania wiedzy, w którym każdy naukowiec, od Demokryta po Chadwicka i Schrödingera, wnosił swój element do tej niezwykle złożonej układanki. To fascynujący przykład tego, jak nauka buduje się na ramionach gigantów, nieustannie weryfikując i udoskonalając wcześniejsze teorie.
Kto zasługuje na miano odkrywcy atomu? Rozwiewamy wątpliwości
Zatem, kto odkrył atom? Nie ma jednej prostej odpowiedzi. Jeśli szukamy twórcy pierwszej naukowej teorii atomistycznej, opartej na dowodach, to bez wątpienia jest nim John Dalton. Jeśli pytamy o odkrywcę cząstek subatomowych, to J. J. Thomson odkrył elektron, a Ernest Rutherford jądro atomowe. James Chadwick dopełnił obraz, odkrywając neutron. Nie możemy też zapomnieć o intuicji Demokryta czy przełomowych badaniach Marii Skłodowskiej-Curie nad promieniotwórczością, które ujawniły złożoność atomu. Każda z tych postaci jest kluczowym elementem tej wielkiej narracji, a ich wspólny wkład pozwolił nam zrozumieć materię na najbardziej fundamentalnym poziomie.
Przeczytaj również: Sekret dipola: Dlaczego niektóre cząsteczki są "magnesami"?
Jak ewolucja wiedzy o atomie wpływa na nasze życie dzisiaj?
Wiedza o atomie, która ewoluowała przez tysiąclecia, ma dziś kolosalne, wręcz niewyobrażalne, praktyczne zastosowania. To dzięki niej rozumiemy i potrafimy kontrolować reakcje jądrowe, co umożliwiło rozwój energii jądrowej źródła, które może zapewnić czystą energię dla milionów. W medycynie, zrozumienie atomu i jego przemian pozwoliło na rozwój diagnostyki obrazowej (np. rezonans magnetyczny, tomografia PET), a także zaawansowanych metod radioterapii w walce z rakiem. W przemyśle atom jest kluczem do tworzenia nowoczesnych materiałów o niespotykanych właściwościach, od lekkich stopów po zaawansowane półprzewodniki, które napędzają naszą elektronikę i komputery. Nawet w rolnictwie, dzięki izotopom, możemy badać procesy w roślinach i glebie. Krótko mówiąc, ewolucja wiedzy o atomie to nie tylko akademicka ciekawostka, ale fundament, na którym zbudowana jest znaczna część naszego współczesnego świata.