Ten artykuł wyjaśnia, kiedy atom jest elektrycznie obojętny, koncentrując się na fundamentalnej równowadze między protonami a elektronami. Zrozumienie tej zasady jest kluczowe dla każdego, kto zaczyna swoją przygodę z chemią, ponieważ stanowi podstawę dla dalszego poznawania reakcji i wiązań chemicznych. Jako Daniel Kowalski, postaram się przedstawić to zagadnienie w sposób jak najbardziej przystępny i zrozumiały.
Atom jest elektrycznie obojętny, gdy liczba protonów i elektronów jest równa klucz do zrozumienia chemii
- Atom jest elektrycznie obojętny, gdy liczba dodatnio naładowanych protonów w jądrze jest dokładnie równa liczbie ujemnie naładowanych elektronów krążących wokół niego.
- Protony mają ładunek +1, elektrony ładunek -1; ich wzajemne znoszenie się daje zerowy ładunek wypadkowy atomu.
- Neutrony, choć znajdują się w jądrze, nie posiadają ładunku elektrycznego i nie wpływają na obojętność atomu.
- Zaburzenie tej równowagi (utrata lub zyskanie elektronów) prowadzi do powstania jonów dodatnich kationów lub ujemnych anionów.
- Zrozumienie obojętności atomu jest fundamentem dla pojmowania reakcji chemicznych i tworzenia wiązań.
Co to znaczy, że atom jest "obojętny elektrycznie"? Prosta definicja dla każdego
Kiedy mówimy, że atom jest "obojętny elektrycznie", mamy na myśli, że jego całkowity ładunek elektryczny wynosi zero. Dzieje się tak, gdy suma wszystkich dodatnich ładunków w atomie idealnie równoważy sumę wszystkich ładunków ujemnych. To trochę jak waga szalkowa jeśli po obu stronach położymy identyczne ciężary, waga pozostaje w równowadze. W przypadku atomu, "ciężarami" są cząstki subatomowe, które posiadają ładunek elektryczny.
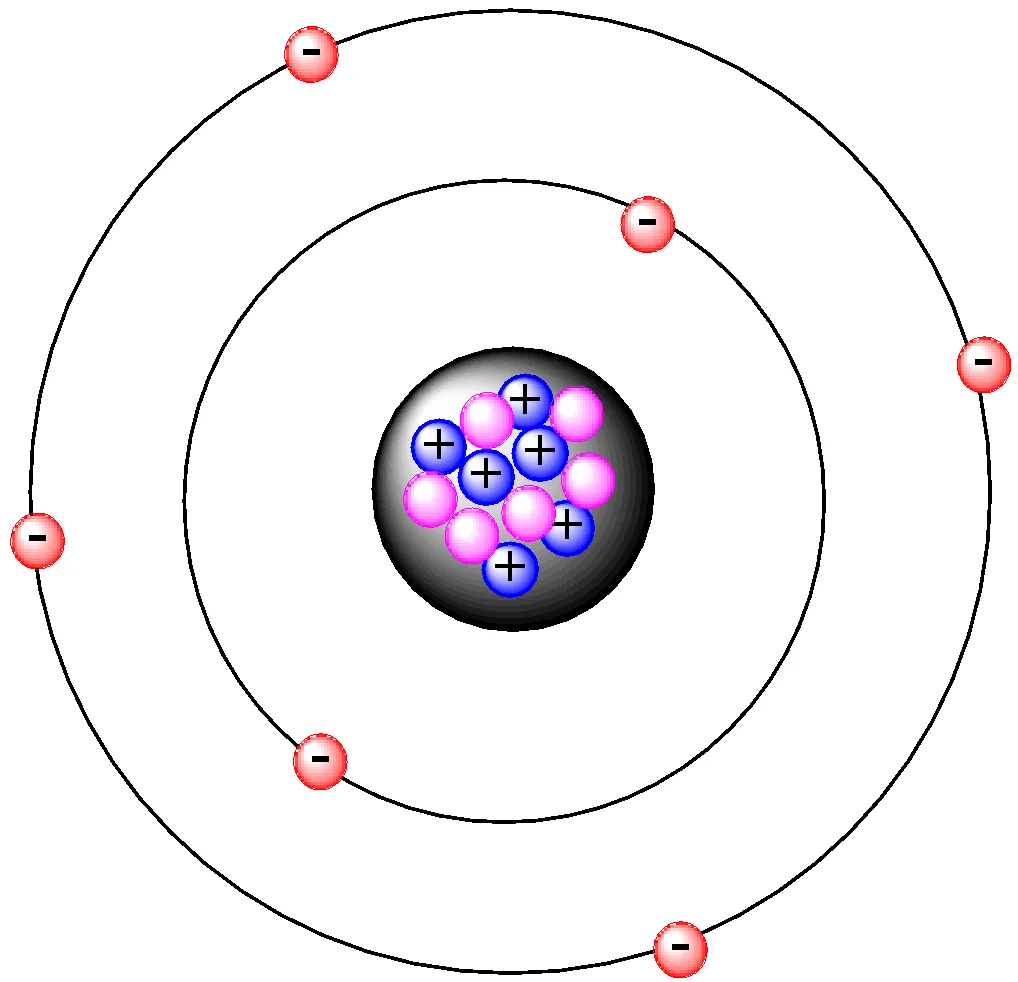
Trzy fundamentalne cząstki: poznaj role protonu, neutronu i elektronu
Aby zrozumieć obojętność atomu, musimy najpierw poznać jego podstawowe składniki. Atom składa się z trzech głównych typów cząstek subatomowych, z których każda odgrywa inną rolę:
- Protony: Znajdują się w samym centrum atomu, w tak zwanym jądrze atomowym. Każdy proton posiada dodatni ładunek elektryczny (+1). To właśnie liczba protonów definiuje, z jakim pierwiastkiem chemicznym mamy do czynienia.
- Neutrony: Podobnie jak protony, neutrony również znajdują się w jądrze atomowym. Ich kluczową cechą jest to, że nie posiadają żadnego ładunku elektrycznego są obojętne. Wpływają na masę atomu i stabilność jądra, ale nie na jego ładunek.
- Elektrony: Krążą wokół jądra atomowego na tak zwanych powłokach elektronowych. Każdy elektron niesie ze sobą ujemny ładunek elektryczny (-1). Są znacznie lżejsze od protonów i neutronów i to właśnie ich liczba jest kluczowa dla elektrycznej obojętności atomu.
Kluczowa zasada: kiedy dodatnie ładunki protonów idealnie równoważą ujemne ładunki elektronów
Jak już wspomniałem, obojętność elektryczna atomu jest wynikiem perfekcyjnej równowagi. Każdy proton wnosi +1 ładunku, a każdy elektron -1. Aby atom był obojętny, liczba protonów musi być dokładnie równa liczbie elektronów. Tylko wtedy ich ładunki wzajemnie się zneutralizują, dając w sumie ładunek zerowy. Jeśli na przykład atom ma 5 protonów, to aby był obojętny, musi mieć również 5 elektronów. To proste, ale fundamentalne prawo, które rządzi światem chemii.
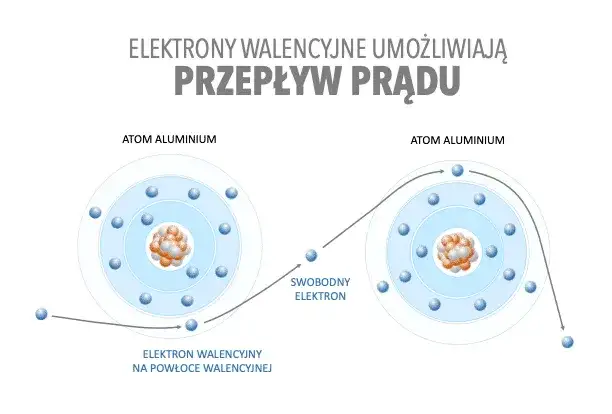
Atom elektrycznie obojętny w praktyce przykłady
Teoretyczne zasady najlepiej zrozumieć na konkretnych przykładach. Przyjrzyjmy się kilku atomom, które doskonale ilustrują zasadę obojętności elektrycznej.
Atom wodoru (H): najprostszy model idealnej równowagi
Atom wodoru jest najprostszym i najbardziej rozpowszechnionym pierwiastkiem we wszechświecie. W swojej najbardziej typowej formie, posiada jeden proton w jądrze i jeden elektron krążący wokół niego. Ładunek +1 od protonu i ładunek -1 od elektronu idealnie się znoszą, co czyni atom wodoru elektrycznie obojętnym. To piękny przykład minimalizmu i doskonałej równowagi.
Atom węgla (C): jak sześć protonów i sześć elektronów tworzy stabilną podstawę życia
Węgiel to pierwiastek, bez którego życie, jakie znamy, nie mogłoby istnieć. Atom węgla jest nieco bardziej złożony niż wodór, ale zasada pozostaje ta sama. Typowy atom węgla posiada sześć protonów w jądrze i sześć elektronów na powłokach. Sześć dodatnich ładunków protonów jest zrównoważonych przez sześć ujemnych ładunków elektronów, co sprawia, że atom węgla jest również elektrycznie obojętny. Ta stabilność jest kluczowa dla jego zdolności do tworzenia niezliczonych związków chemicznych.
Rola liczby atomowej (Z) w określaniu neutralności pierwiastka
Tutaj wkracza pojęcie liczby atomowej, oznaczanej literą Z. Liczba atomowa to nic innego jak liczba protonów w jądrze atomu. Jest to unikalna cecha każdego pierwiastka chemicznego. Na przykład, wodór ma Z=1, węgiel Z=6, a tlen Z=8. Co to oznacza dla obojętności elektrycznej? Otóż, w elektrycznie obojętnym atomie, liczba elektronów jest zawsze równa liczbie atomowej (Z). Jeśli więc znamy Z pierwiastka, automatycznie wiemy, ile elektronów posiada jego obojętny atom. To bardzo praktyczna zasada!
Gdy atom traci neutralność powstawanie jonów
Co się dzieje, gdy ta delikatna równowaga między protonami a elektronami zostaje zaburzona? Wtedy atom przestaje być obojętny elektrycznie i staje się jonem. To kluczowy proces w chemii, prowadzący do tworzenia wiązań i związków.
Gdy elektronów jest za mało: jak powstaje jon dodatni, czyli kation (np. Na⁺)
Wyobraźmy sobie atom, który z jakiegoś powodu traci jeden lub więcej elektronów. Ponieważ elektrony są ujemnie naładowane, ich utrata oznacza, że w atomie pozostaje więcej dodatnio naładowanych protonów niż ujemnie naładowanych elektronów. W efekcie atom zyskuje wypadkowy ładunek dodatni i staje się kationem. Klasycznym przykładem jest atom sodu (Na), który ma 11 protonów i 11 elektronów. Kiedy traci jeden elektron, staje się jonem sodu (Na⁺), posiadającym 11 protonów i tylko 10 elektronów, co daje mu ładunek +1.
Gdy elektronów jest za dużo: droga do powstania jonu ujemnego, czyli anionu (np. Cl⁻)
Z drugiej strony, atom może również przyjąć dodatkowe elektrony. W takim przypadku liczba ujemnie naładowanych elektronów przewyższa liczbę dodatnio naładowanych protonów. Atom zyskuje wtedy wypadkowy ładunek ujemny i staje się anionem. Dobrym przykładem jest atom chloru (Cl), który ma 17 protonów i 17 elektronów. Gdy przyjmie jeden dodatkowy elektron, staje się jonem chlorkowym (Cl⁻), mającym 17 protonów i 18 elektronów, co daje mu ładunek -1.
Od obojętnego atomu do związku chemicznego: jak jony tworzą wiązania jonowe
Powstawanie kationów i anionów nie jest celem samym w sobie. Te naładowane cząstki, posiadające przeciwne ładunki, silnie się do siebie przyciągają. To właśnie to przyciąganie elektrostatyczne jest siłą napędową tworzenia wiązań jonowych, które są podstawą wielu związków chemicznych, takich jak choćby dobrze znana sól kuchenna (chlorek sodu, NaCl). Zrozumienie, jak atom staje się jonem, jest więc kluczowe do pojęcia, jak powstaje materia wokół nas.
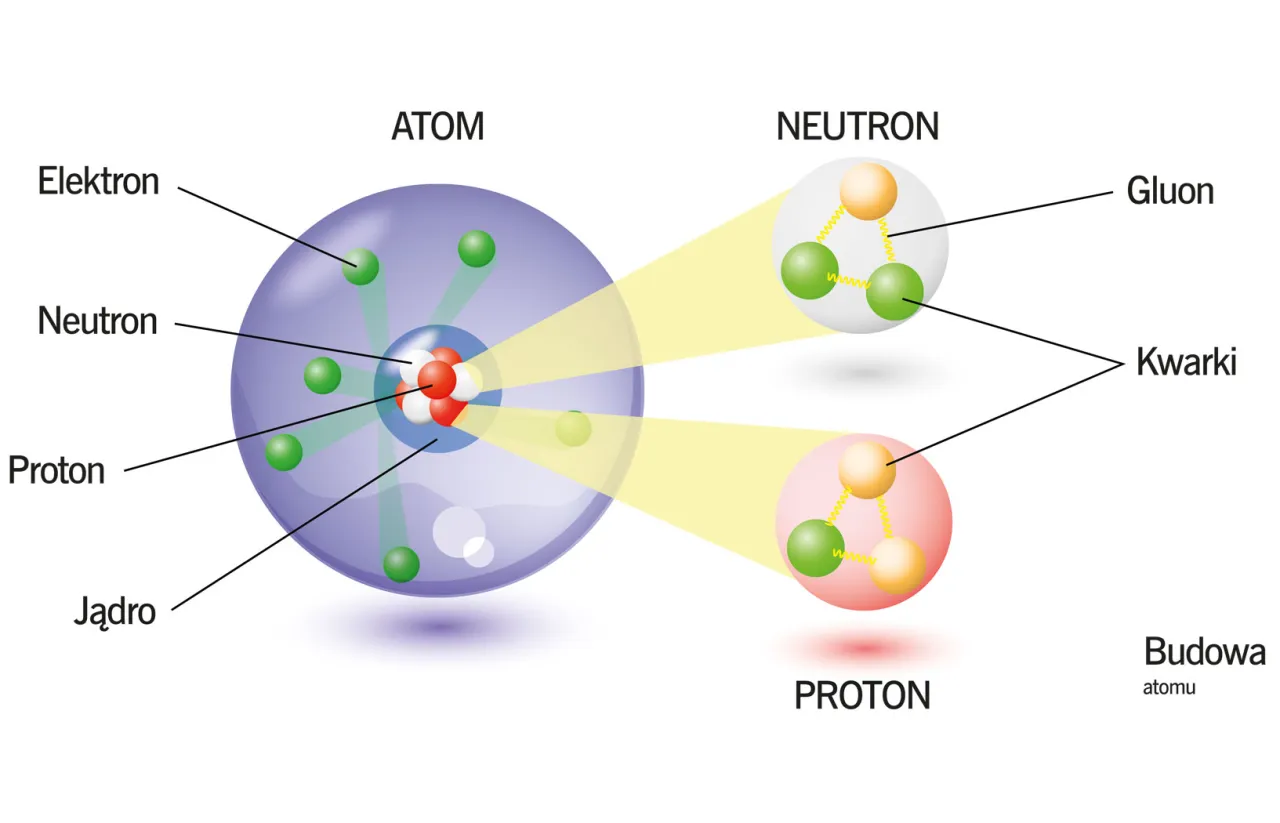
Neutrony cisi bohaterowie w jądrze atomowym
Często, gdy mówimy o ładunku atomu, skupiamy się na protonach i elektronach. Jednak nie możemy zapomnieć o neutronach, które, choć nie wpływają na ładunek, są niezwykle ważne dla istnienia atomu.
Dlaczego neutrony, mimo że są w jądrze, nie zmieniają ładunku atomu?
Odpowiedź jest prosta i tkwi w samej definicji neutronu: neutrony są elektrycznie obojętne. Oznacza to, że nie posiadają ani ładunku dodatniego, ani ujemnego. Ich obecność w jądrze atomowym, obok protonów, nie wpływa więc na ogólny bilans ładunków elektrycznych atomu. Niezależnie od tego, ile neutronów znajduje się w jądrze, atom pozostaje elektrycznie obojętny, dopóki liczba protonów równa jest liczbie elektronów.
Jak neutrony wpływają na stabilność i masę atomu, pozostawiając go elektrycznie obojętnym
Mimo swojej obojętności elektrycznej, neutrony odgrywają kluczową rolę w atomie. Przede wszystkim znacznie zwiększają masę atomową, ponieważ mają masę zbliżoną do masy protonów. Co więcej, są one niezbędne do stabilizacji jądra atomowego. Protony, wszystkie naładowane dodatnio, naturalnie odpychałyby się nawzajem, co mogłoby doprowadzić do rozpadu jądra. Neutrony działają jak "klej", wiążąc protony razem za pomocą silnych sił jądrowych, zapewniając stabilność atomu. Bez nich większość pierwiastków, jakie znamy, po prostu by nie istniała.
Obojętność elektryczna atomu fundament chemii
Podsumowując, koncepcja elektrycznej obojętności atomu to nie tylko sucha definicja. To podstawa, na której budujemy całe nasze rozumienie świata chemii.
Jak neutralność atomu wpływa na jego zdolność do wchodzenia w reakcje chemiczne
Atomy nieustannie dążą do osiągnięcia stabilnej konfiguracji elektronowej, a często oznacza to dążenie do obojętności elektrycznej lub, w przypadku tworzenia związków, do stabilnego stanu jonowego. To dążenie jest główną siłą napędową wszystkich reakcji chemicznych. Atomy "chcą" oddawać, przyjmować lub uwspólniać elektrony, aby osiągnąć stan energetyczny, który jest dla nich najbardziej korzystny. Zrozumienie, kiedy atom jest obojętny, pozwala nam przewidywać, jak będzie reagował i jakie wiązania będzie tworzył.
Przeczytaj również: Jak zdać maturę z chemii na 100%? Sprawdzone strategie 2026
Atom obojętny jako punkt wyjścia do całego świata chemii
Dla mnie, jako eksperta, jasne jest, że zrozumienie, kiedy atom jest elektrycznie obojętny, jest fundamentalnym krokiem dla każdego, kto chce zgłębiać tajniki chemii. To jak nauka alfabetu przed czytaniem książek. Bez tej podstawowej wiedzy trudno jest pojąć bardziej złożone koncepcje, takie jak wiązania chemiczne, reakcje redoks czy budowa cząsteczek. Mam nadzieję, że ten artykuł pomógł Ci rozświetlić to kluczowe zagadnienie i zachęcił do dalszego poznawania fascynującego świata atomów i molekuł.