Cześć! Daniel Kowalski tutaj. Jeśli kiedykolwiek zastanawiałeś się, jak narysować uproszczony model atomu, ten przewodnik jest właśnie dla Ciebie. To fundamentalna umiejętność w chemii i fizyce, która pomoże Ci zrozumieć, jak zbudowany jest świat na poziomie mikroskopowym. Przygotuj ołówek i kartkę pokażę Ci krok po kroku, jak to zrobić!
Jak łatwo narysować model atomu praktyczny przewodnik krok po kroku
- Zrozumienie budowy atomu: Jądro (protony, neutrony) i elektrony na powłokach.
- Klucz do danych: Odczytywanie liczby atomowej (Z) i masowej (A) z układu okresowego.
- Kolejność rysowania: Zacznij od jądra, dodaj powłoki, a następnie rozmieść elektrony.
- Pojemność powłok: Pamiętaj o maksymalnej liczbie elektronów na każdej powłoce (2n²).
- Elektrony walencyjne: Ich liczba na ostatniej powłoce decyduje o właściwościach chemicznych.
- Iony: Modele jonów różnią się liczbą elektronów od atomów obojętnych.
Podstawy budowy atomu, które musisz znać
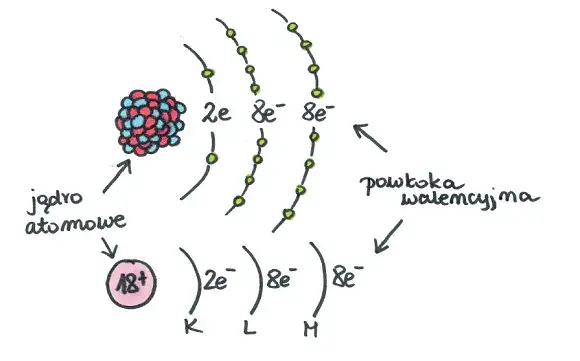
Zanim zaczniemy rysować, musimy zrozumieć, z czego składa się atom. To jak budowanie domu najpierw musimy poznać jego fundamenty i cegły. Atom składa się z dwóch głównych części: centralnie położonego jądra atomowego oraz krążących wokół niego elektronów. Jądro jest dodatnio naładowane, a elektrony ujemnie. Co ważne, w atomie obojętnym elektrycznie, liczba dodatnich ładunków w jądrze jest zawsze równa liczbie ujemnych ładunków elektronów.
Jądro atomowe: Serce Twojego modelu
Jądro atomowe to prawdziwe serce każdego atomu. Jest ono niezwykle małe, ale za to bardzo gęste i zawiera prawie całą masę atomu. W jego skład wchodzą dwa rodzaje cząstek: protony (oznaczane jako p+) i neutrony (oznaczane jako n⁰). Protony mają ładunek dodatni, natomiast neutrony, jak sama nazwa wskazuje, są elektrycznie obojętne. Liczba protonów w jądrze jest kluczowa to ona decyduje o tym, jaki to pierwiastek chemiczny i nazywamy ją liczbą atomową (Z). Liczbę neutronów obliczysz, odejmując liczbę atomową (Z) od liczby masowej (A), czyli N = A - Z. To proste równanie, które zawsze się sprawdza!Elektrony: Klucz do zrozumienia chemii
Teraz przejdźmy do elektronów (e-). Są to maleńkie cząstki o ładunku ujemnym, które krążą wokół jądra atomowego. W atomie, który jest elektrycznie obojętny, liczba elektronów jest zawsze równa liczbie protonów. To bardzo ważna zasada, którą musisz zapamiętać! Elektrony nie krążą jednak chaotycznie. Poruszają się po określonych obszarach, które nazywamy powłokami elektronowymi. Te elektrony, które znajdują się na najbardziej zewnętrznej powłoce, nazywane są elektronami walencyjnymi. To właśnie one są odpowiedzialne za właściwości chemiczne pierwiastka i decydują o tym, jak atom będzie reagował z innymi atomami.Powłoki elektronowe: Gdzie mieszkają elektrony?
Powłoki elektronowe to takie "piętra" wokół jądra, na których rozmieszczone są elektrony. Oznaczamy je kolejnymi literami alfabetu, zaczynając od jądra: K, L, M, N... lub numerami kwantowymi n=1, 2, 3... Każda powłoka ma określoną, maksymalną liczbę elektronów, jaką może pomieścić. Tę pojemność można obliczyć za pomocą prostego wzoru: 2n², gdzie 'n' to numer powłoki. Zrozumienie tego jest kluczowe, aby poprawnie rozmieścić elektrony w swoim modelu.
- Powłoka K (n=1): Maksymalnie 2 * 1² = 2 elektrony.
- Powłoka L (n=2): Maksymalnie 2 * 2² = 8 elektronów.
- Powłoka M (n=3): Maksymalnie 2 * 3² = 18 elektronów.
Układ okresowy pierwiastków Twój przewodnik po atomach
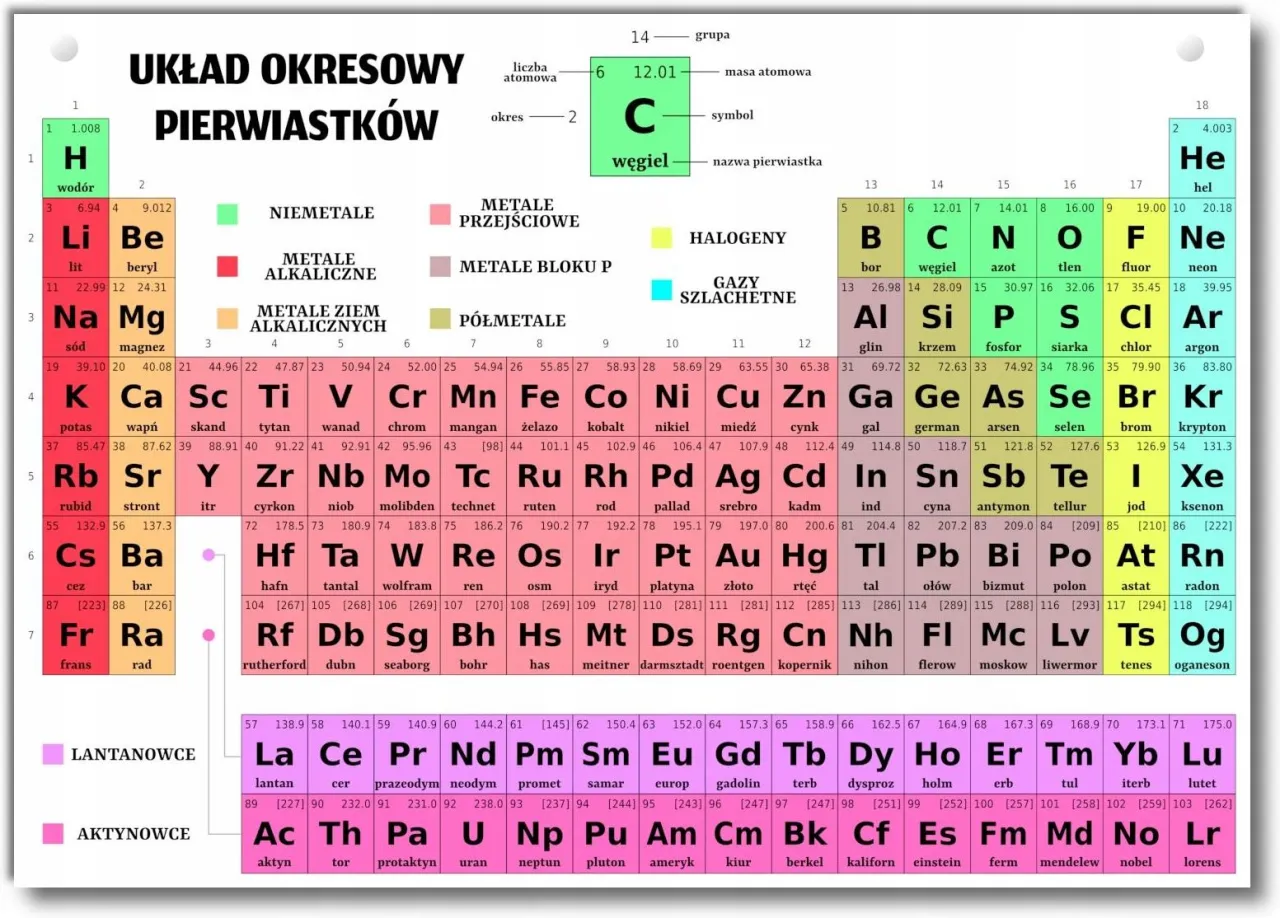
Układ okresowy pierwiastków to prawdziwa "ściąga" dla każdego chemika i fizyka. Znajdziesz w nim wszystkie niezbędne informacje, które pozwolą Ci narysować model atomu dla niemal każdego pierwiastka. To Twoje podstawowe narzędzie pracy, które musisz nauczyć się efektywnie wykorzystywać. Każdy pierwiastek w układzie ma swoją "wizytówkę", na której znajdziesz między innymi liczbę atomową i masową.
Liczba atomowa (Z): Dowód tożsamości pierwiastka
Liczba atomowa (Z) to unikalny numer dla każdego pierwiastka. Znajdziesz ją zazwyczaj w lewym górnym rogu symbolu pierwiastka w układzie okresowym. Jest to nic innego jak liczba protonów w jądrze atomu. A co najważniejsze, w atomie obojętnym elektrycznie, liczba atomowa jest również równa liczbie elektronów. Jeśli więc widzisz, że Z=6 (jak dla węgla), wiesz, że atom węgla ma 6 protonów i 6 elektronów.
Liczba masowa (A): Jak obliczyć liczbę neutronów?
Liczba masowa (A) to suma protonów i neutronów w jądrze atomu. Zazwyczaj jest to liczba dziesiętna (średnia ważona izotopów), ale do celów rysowania modelu atomu zawsze zaokrąglamy ją do najbliższej liczby całkowitej. Liczbę masową znajdziesz pod symbolem pierwiastka w układzie okresowym. Aby obliczyć liczbę neutronów (N), wystarczy odjąć liczbę atomową (Z) od liczby masowej (A): N = A - Z. Proste, prawda?
Numer grupy i okresu: Droga na skróty do elektronów walencyjnych
Numer grupy (kolumny) i okresu (rzędu) w układzie okresowym to cenne wskazówki. Numer okresu mówi nam, ile powłok elektronowych posiada atom. Na przykład, pierwiastek z 3. okresu będzie miał trzy powłoki (K, L, M). Natomiast numer grupy (dla grup głównych, czyli 1-2 i 13-18) pozwala nam szybko określić liczbę elektronów walencyjnych. Dla grup 1 i 2 liczba elektronów walencyjnych jest równa numerowi grupy. Dla grup od 13 do 18 odejmujemy od numeru grupy liczbę 10. Czyli pierwiastek z grupy 17 ma 17 - 10 = 7 elektronów walencyjnych.
Narysujmy model atomu sodu (Na) instrukcja krok po kroku
Teraz, gdy znamy już wszystkie podstawy, przejdźmy do praktyki! Narysujemy model atomu sodu (Na). Sód to świetny przykład, który pozwoli nam przećwiczyć wszystkie omówione zasady. Przygotuj się na to, że atom sodu ma 11 protonów, 12 neutronów, a jego elektrony rozmieszczone są na trzech powłokach: 2 elektrony na K, 8 na L i 1 na M.
Krok 1: Ustal liczbę protonów, neutronów i elektronów
Znajdź sód (Na) w układzie okresowym. Odczytasz, że jego liczba atomowa (Z) wynosi 11, a liczba masowa (A) to około 23 (po zaokrągleniu).
- Liczba protonów (p+): Z = 11
- Liczba elektronów (e-): W atomie obojętnym = Z = 11
- Liczba neutronów (n⁰): A - Z = 23 - 11 = 12
Krok 2: Narysuj jądro atomowe centrum dowodzenia
Na środku kartki narysuj małe kółko. Będzie ono symbolizowało jądro atomowe. W jego wnętrzu wpisz liczbę protonów i neutronów, które obliczyłeś w poprzednim kroku. Dla sodu będzie to: '11p+ 12n⁰'. To bardzo ważne, aby jądro było wyraźnie oznaczone.
Krok 3: Dodaj powłoki elektronowe we właściwej kolejności
Teraz narysuj łuki lub okręgi wokół jądra. Będą one symbolizować powłoki elektronowe. Pamiętasz, że sód jest w 3. okresie układu okresowego? To oznacza, że ma trzy powłoki elektronowe: K, L i M. Narysuj więc trzy koncentryczne okręgi wokół jądra, zaczynając od najbliższego (K) i kończąc na najbardziej zewnętrznym (M).
Krok 4: Rozmieść elektrony od pierwszej do ostatniej powłoki
Mamy 11 elektronów do rozmieszczenia. Pamiętaj o maksymalnej pojemności każdej powłoki:
- Powłoka K (n=1): Może pomieścić maksymalnie 2 elektrony. Umieść na niej 2 elektrony (np. jako kropki lub małe kółka).
- Powłoka L (n=2): Może pomieścić maksymalnie 8 elektronów. Po zapełnieniu powłoki K, pozostało nam 11 - 2 = 9 elektronów. Na powłoce L umieść więc 8 elektronów.
- Powłoka M (n=3): Po zapełnieniu powłok K i L pozostał nam 11 - 2 - 8 = 1 elektron. Umieść go na powłoce M. Ten jeden elektron na najbardziej zewnętrznej powłoce to nasz elektron walencyjny.
Krok 5: Sprawdź swój rysunek czy wszystko się zgadza?
Zawsze warto poświęcić chwilę na sprawdzenie swojego rysunku. Upewnij się, że:
- Liczba protonów i neutronów w jądrze jest poprawna.
- Sumaryczna liczba elektronów na wszystkich powłokach zgadza się z liczbą atomową (dla atomu obojętnego).
- Elektrony są rozmieszczone zgodnie z maksymalną pojemnością każdej powłoki (K=2, L=8, M=18...).
- Liczba elektronów walencyjnych odpowiada numerowi grupy (dla grup głównych).
Modele popularnych pierwiastków ćwicz rysowanie!
Praktyka czyni mistrza! Im więcej modeli narysujesz, tym lepiej zrozumiesz budowę atomu i tym łatwiej będzie Ci to przychodziło. Przygotowałem dla Ciebie kilka popularnych przykładów, abyś mógł poćwiczyć i utrwalić zdobytą wiedzę. Spróbuj narysować je samodzielnie, zanim przeczytasz moje opisy!
Jak narysować prosty model atomu wodoru (H)?
Wodór (H) to najprostszy atom. Ma Z=1, A≈1. Oznacza to, że jego jądro zawiera 1 proton (1p+) i 0 neutronów (0n⁰). Wokół jądra krąży 1 elektron, który znajduje się na pierwszej powłoce (K). To naprawdę minimalistyczny model!
Model atomu helu (He): Dlaczego ta powłoka jest już pełna?
Hel (He) ma Z=2, A≈4. W jego jądrze znajdziemy 2 protony (2p+) i 2 neutrony (2n⁰). Wokół jądra krążą 2 elektrony, oba na powłoce K. Powłoka K ma maksymalną pojemność 2 elektronów, więc w przypadku helu jest ona już całkowicie zapełniona. To sprawia, że hel jest gazem szlachetnym, bardzo niereaktywnym.
Rysunek atomu węgla (C): Fundament życia
Węgiel (C) to pierwiastek o Z=6, A≈12. Jego jądro zawiera 6 protonów (6p+) i 6 neutronów (6n⁰). Elektrony (jest ich 6) rozmieszczone są na dwóch powłokach: 2 elektrony na powłoce K i 4 elektrony na powłoce L. Te 4 elektrony walencyjne na powłoce L są kluczowe dla zdolności węgla do tworzenia niezliczonych związków organicznych, będących podstawą życia.
Jak wygląda model atomu tlenu (O)?
Tlen (O) ma Z=8, A≈16. W jądrze znajdziemy 8 protonów (8p+) i 8 neutronów (8n⁰). Atom tlenu ma 8 elektronów, które rozmieszczamy następująco: 2 elektrony na powłoce K i 6 elektronów na powłoce L. Sześć elektronów walencyjnych sprawia, że tlen jest bardzo reaktywny i chętnie tworzy wiązania, dążąc do uzyskania pełnej powłoki.
Model atomu chloru (Cl): Sprawdzamy elektrony walencyjne
Chlor (Cl) to pierwiastek z Z=17, A≈35. W jego jądrze znajduje się 17 protonów (17p+) i 18 neutronów (18n⁰). Chlor ma 17 elektronów, które rozmieszczamy na trzech powłokach: 2 elektrony na powłoce K, 8 elektronów na powłoce L i 7 elektronów na powłoce M. Te 7 elektronów walencyjnych na ostatniej powłoce sprawia, że chlor jest bardzo reaktywny i chętnie przyjmuje jeden elektron, tworząc jon chlorkowy.
Modele jonów jak rysować atomy z ładunkiem?
Do tej pory rysowaliśmy modele atomów obojętnych elektrycznie, czyli takich, w których liczba protonów była równa liczbie elektronów. Ale co, jeśli atom straci lub zyska elektrony? Wtedy staje się jonem cząstką z ładunkiem elektrycznym! Rysowanie jonów jest bardzo podobne do rysowania atomów, z tą kluczową różnicą, że zmieniamy liczbę elektronów, a nie protonów czy neutronów.
Tworzenie kationu: Co się dzieje, gdy atom traci elektrony (przykład Na+)?
Kation to jon o ładunku dodatnim. Powstaje, gdy atom oddaje jeden lub więcej elektronów. Spójrzmy na jon sodu (Na+). Atom sodu (Na) ma 11 protonów, 12 neutronów i 11 elektronów (2 na K, 8 na L, 1 na M). Aby stać się kationem Na+, atom sodu oddaje swój jeden elektron walencyjny z powłoki M. W rezultacie jon Na+ będzie miał nadal 11p+ i 12n⁰ w jądrze, ale tylko 10e- (2 na K, 8 na L). Pamiętaj, liczba protonów nigdy się nie zmienia!
Tworzenie anionu: Co się dzieje, gdy atom zyskuje elektrony (przykład Cl-)?
Anion to jon o ładunku ujemnym. Powstaje, gdy atom przyjmuje jeden lub więcej elektronów. Weźmy przykład jonu chlorkowego (Cl-). Atom chloru (Cl) ma 17 protonów, 18 neutronów i 17 elektronów (2 na K, 8 na L, 7 na M). Aby stać się anionem Cl-, atom chloru przyjmuje jeden elektron na swoją powłokę walencyjną M. W efekcie jon Cl- będzie miał nadal 17p+ i 18n⁰ w jądrze, ale już 18e- (2 na K, 8 na L, 8 na M). Ponownie, liczba protonów pozostaje niezmieniona.
Kluczowe różnice w rysunku: Czym model jonu różni się od modelu atomu?
Podsumowując, rysując modele jonów, pamiętaj o tych kluczowych różnicach:
- Liczba elektronów: To główna zmiana. Kationy mają mniej elektronów niż atom obojętny, a aniony mają ich więcej.
- Ładunek: Warto zaznaczyć ładunek jonu obok symbolu pierwiastka na rysunku (np. Na+, Cl-), aby podkreślić, że to jon, a nie atom obojętny.
- Jądro bez zmian: Liczba protonów i neutronów w jądrze zawsze pozostaje taka sama.
Unikaj tych błędów, rysując modele atomów!
Rysowanie modeli atomów jest dość proste, ale łatwo popełnić kilka typowych błędów. Chcę, żebyś był ich świadomy i wiedział, jak ich unikać. Uważność to klucz do sukcesu!
Błąd 1: Zła liczba neutronów w jądrze
Bardzo częstym błędem jest nieprawidłowe obliczenie liczby neutronów. Czasami uczniowie mylą liczbę masową z liczbą atomową lub zapominają o zaokrągleniu liczby masowej. Zawsze pamiętaj o wzorze: N = A - Z, gdzie A to zaokrąglona liczba masowa, a Z to liczba atomowa. Sprawdź dwukrotnie te wartości w układzie okresowym!
Błąd 2: Ignorowanie maksymalnej pojemności powłok elektronowych
Inny powszechny błąd to umieszczanie zbyt wielu lub zbyt mało elektronów na danej powłoce. Pamiętaj, że każda powłoka ma swoją "pojemność". Powłoka K zawsze pomieści maksymalnie 2 elektrony, powłoka L 8, a powłoka M 18. Zawsze zaczynaj od zapełniania powłok od najbliższej jądra, czyli od K, a następnie przechodź do L, M itd., aż rozmieścisz wszystkie elektrony. Wzór 2n² jest tu Twoim najlepszym przyjacielem.
Przeczytaj również: Chemia do basenu na start: Poradnik krok po kroku. Czysta woda bez problemów!
Błąd 3: Pomyłka w liczbie elektronów walencyjnych
Elektrony walencyjne są niezwykle ważne, więc ich błędne określenie może prowadzić do nieporozumień. Upewnij się, że poprawnie odczytujesz ich liczbę z układu okresowego dla pierwiastków grup 1-2 i 13-18 (grup głównych) numer grupy (lub numer grupy minus 10) wskaże Ci liczbę elektronów na ostatniej powłoce. Zawsze sprawdź, czy liczba elektronów na ostatniej powłoce zgadza się z tym, co wynika z położenia pierwiastka w układzie okresowym.