W świecie chemii, zrozumienie pojęcia materii jest absolutnie fundamentalne. To nic innego jak wszystko, co nas otacza od powietrza, którym oddychamy, po gwiazdy na nocnym niebie. Dla każdego, kto chce zgłębić tajniki chemii, kluczowe jest uchwycenie, czym materia jest, z czego się składa i jak się zachowuje.
Materia to wszystko, co nas otacza poznaj jej budowę i kluczowe cechy
- Materia to wszystko, co posiada masę i zajmuje określoną objętość, a jej podstawowymi składnikami są atomy i cząsteczki.
- Występuje w trzech głównych stanach skupienia: stałym, ciekłym i gazowym, a także w stanie plazmy.
- Dzieli się na substancje czyste (pierwiastki, związki) oraz mieszaniny (jednorodne, niejednorodne).
- Posiada właściwości fizyczne (np. barwa, gęstość) i chemiczne (np. palność), które pozwalają ją opisać.
- Prawo zachowania masy jest fundamentalną zasadą, mówiącą, że materia nie ginie w reakcjach chemicznych.

Czym jest materia: podstawowa definicja dla każdego
W chemii, materia jest pojęciem absolutnie kluczowym, definiującym wszystko, co ma masę i zajmuje objętość, czyli przestrzeń. Kiedy rozglądam się wokół, widzę ją wszędzie w moim biurku, w powietrzu, którym oddycham, a nawet w świetle słonecznym, które choć samo nie jest materią, to pochodzi z procesów zachodzących w materii gwiazd. Zrozumienie tej podstawowej definicji to pierwszy krok do poznania całego chemicznego świata.
Dwie kluczowe cechy: masa i objętość
Kiedy mówimy o materii, zawsze podkreślamy dwie jej kluczowe cechy: posiadanie masy i zajmowanie objętości. Masa to miara ilości materii w danym obiekcie im więcej materii, tym większa masa. Objętość natomiast to przestrzeń, którą ta materia zajmuje. Weźmy na przykład kamień: ma on określoną masę, którą możemy zmierzyć na wadze, i zajmuje konkretną objętość, co widać, gdy wrzucimy go do wody i poziom cieczy się podniesie. Nawet powietrze, choć niewidoczne, ma masę i zajmuje objętość wystarczy pomyśleć o nadmuchanym balonie, który jest cięższy i większy niż pusty.
Dlaczego wszystko wokół nas, od powietrza po stal, jest materią?
Na podstawie tej definicji łatwo zrozumieć, dlaczego tak różnorodne obiekty, jak powietrze, woda, skały czy stal, są przykładami materii. Powietrze, choć wydaje się puste, składa się z cząsteczek gazów, które mają masę i zajmują przestrzeń. Woda, którą pijemy, to zbiór cząsteczek H₂O, każda z nich ma masę i objętość. Skały to konglomeraty minerałów, a każdy z tych minerałów to materia. Nawet światło gwiazd, choć samo w sobie jest energią (fotonami), jest wynikiem reakcji jądrowych zachodzących w gigantycznych ilościach materii gazów takich jak wodór i hel. Wszystko, co możemy dotknąć, poczuć, zmierzyć, a nawet to, co jest niewidoczne, ale ma masę i zajmuje miejsce, to materia.
Ziarnista budowa materii: świat w skali mikro
Jedną z najbardziej fascynujących koncepcji w chemii jest ziarnista budowa materii. Oznacza to, że materia nie jest jednolita i ciągła, ale składa się z niezwykle małych, niewidocznych gołym okiem cząstek. Mogą to być atomy, jony lub cząsteczki. Co więcej, te maleńkie cząstki nigdy nie są w bezruchu są w ciągłym, chaotycznym ruchu, drgając, obracając się i zderzając ze sobą. To właśnie ten ruch i sposób upakowania cząstek decydują o wielu właściwościach materii, w tym o jej stanie skupienia, o czym opowiem za chwilę.
Od atomu do cząsteczki: z czego zbudowana jest materia?
Kiedy już wiemy, że materia ma ziarnistą budowę, naturalnie pojawia się pytanie: z jakich konkretnie "ziaren" się składa? Odpowiedź prowadzi nas do dwóch podstawowych pojęć w chemii: atomów i cząsteczek. To one są cegiełkami, z których zbudowany jest cały wszechświat, a ich zrozumienie to podstawa do dalszej nauki.
Atom: podstawowy budulec wszechświata
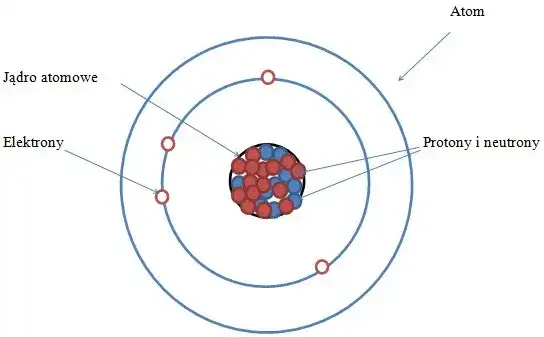
Atom to najmniejsza, podstawowa cząstka materii, która zachowuje wszystkie właściwości danego pierwiastka chemicznego. Wyobraź sobie, że masz kawałek złota i dzielisz go na coraz mniejsze części. W końcu dojdziesz do punktu, w którym dalszy podział sprawi, że nie będzie to już złoto, ale coś zupełnie innego. Ta najmniejsza "złota" cząstka to właśnie atom złota. Atomy są niezwykle małe, ale to one decydują o tym, czym jest dana substancja i jak będzie się zachowywać.
Pierwiastki, czyli zbiory takich samych atomów
Gdy mówimy o pierwiastkach chemicznych, mamy na myśli zbiory atomów tego samego rodzaju. Każdy atom danego pierwiastka ma tę samą liczbę protonów w jądrze, co jest jego "numerem identyfikacyjnym". Pierwiastki to podstawowe substancje, których nie da się rozłożyć na prostsze składniki za pomocą metod chemicznych. Przykładami pierwiastków są dobrze nam znane substancje, takie jak żelazo (Fe), tlen (O) czy węgiel (C). Każdy z nich składa się z atomów o tych samych, unikalnych cechach.
Cząsteczki: gdy atomy łączą się w zespoły
Często jednak atomy nie występują pojedynczo. Łączą się ze sobą, tworząc większe struktury zwane cząsteczkami. Cząsteczka to zespół co najmniej dwóch atomów, które są ze sobą połączone silnymi wiązaniami chemicznymi. Najlepszym przykładem jest woda. Jej wzór chemiczny to H₂O, co oznacza, że jedna cząsteczka wody składa się z dwóch atomów wodoru (H) i jednego atomu tlenu (O) połączonych ze sobą. To właśnie te połączenia sprawiają, że cząsteczki mają zupełnie inne właściwości niż pojedyncze atomy, z których się składają.
Jak odróżnić atom od cząsteczki? Proste wyjaśnienie
Aby prosto odróżnić atom od cząsteczki, pomyśl o atomie jako o pojedynczej cegiełce. Jest to podstawowy, niepodzielny element budulcowy. Cząsteczka natomiast to już "konstrukcja" zbudowana z tych cegiełek na przykład ściana zbudowana z wielu cegieł. Pojedynczy atom tlenu (oznaczany jako O) to cegiełka. Ale tlen, którym oddychamy, występuje w postaci cząsteczek składających się z dwóch atomów tlenu połączonych ze sobą (O₂). To właśnie ta różnica czy mamy do czynienia z pojedynczym elementem, czy z zespołem połączonych elementów jest kluczowa.Cztery twarze materii: poznaj jej stany skupienia
Materia nie zawsze wygląda tak samo. W zależności od warunków, takich jak temperatura i ciśnienie, może przybierać różne formy, które nazywamy stanami skupienia. Tradycyjnie wyróżniamy trzy podstawowe stany: stały, ciekły i gazowy, ale coraz częściej mówi się także o plazmie jako czwartym stanie. To, co dzieje się z cząsteczkami w każdym z tych stanów, jest fascynujące i decyduje o ich unikalnych właściwościach.
Ciało stałe: porządek i drgania w miejscu
W ciele stałym cząsteczki są niezwykle gęsto upakowane i ułożone w regularną, uporządkowaną strukturę (zwłaszcza w kryształach). Nie mogą się swobodnie przemieszczać, a jedynie drgają wokół swoich stałych położeń. Dzięki temu ciała stałe mają określony kształt i objętość, a także są trudne do ściśnięcia. Pomyśl o kostce lodu ma swój kształt i objętość, a cząsteczki wody są w niej "zamrożone" w sieci krystalicznej.
Ciecz: swoboda ruchu w określonej objętości
W stanie ciekłym cząsteczki nadal są blisko siebie, ale mają już znacznie większą swobodę ruchu. Mogą się przemieszczać, ślizgając się jedna po drugiej, co sprawia, że ciecze są płynne. Ciecz ma określoną objętość, ale nie ma stałego kształtu zawsze przybiera kształt naczynia, w którym się znajduje. Woda w szklance jest tego doskonałym przykładem zachowuje swoją objętość, ale dopasowuje się do kształtu szklanki.
Gaz: chaos i nieograniczona przestrzeń
W stanie gazowym cząsteczki są bardzo daleko od siebie i poruszają się w sposób całkowicie chaotyczny, z dużą prędkością, zderzając się ze sobą i ze ściankami naczynia. Gaz nie ma ani określonego kształtu, ani objętości zawsze wypełnia całą dostępną przestrzeń. Jeśli otworzysz butelkę perfum, zapach szybko rozprzestrzeni się po całym pomieszczeniu, ponieważ cząsteczki gazu wypełniają każdą wolną przestrzeń.
Plazma: czwarty, zjonizowany stan skupienia
Poza trzema podstawowymi stanami, w bardzo wysokich temperaturach materia może przejść w stan plazmy. To zjonizowany gaz, co oznacza, że atomy zostały pozbawione części swoich elektronów, tworząc mieszaninę jonów i swobodnych elektronów. Plazma przewodzi prąd elektryczny i jest najpowszechniejszym stanem materii we wszechświecie! Spotykamy ją na Słońcu i w innych gwiazdach, w zorzach polarnych, a także w lampach neonowych czy ekranach plazmowych.
Jak chemicy porządkują świat: kluczowy podział materii
Świat materii jest niezwykle różnorodny, dlatego chemicy opracowali system klasyfikacji, który pomaga nam zrozumieć i uporządkować tę różnorodność. Podstawowy podział materii to rozróżnienie na substancje czyste i mieszaniny, a następnie ich dalsze kategoryzowanie. Dzięki temu możemy precyzyjnie opisywać każdą substancję, z którą mamy do czynienia.
Krok pierwszy: substancje czyste kontra mieszaniny
Pierwszym i najważniejszym krokiem w klasyfikacji materii jest odróżnienie substancji czystych od mieszanin. Substancje czyste to takie, które mają stały i określony skład chemiczny oraz ściśle zdefiniowane właściwości, takie jak temperatura topnienia czy wrzenia. Nie da się ich rozdzielić na prostsze składniki metodami fizycznymi. Mieszaniny natomiast to układy składające się z co najmniej dwóch różnych substancji, które nie są ze sobą trwale połączone chemicznie. Mogą mieć zmienny skład, a ich właściwości są wypadkową właściwości składników.
Rozkładamy na czynniki pierwsze: pierwiastki i związki chemiczne
Substancje czyste dzielimy dalej na dwie główne kategorie:
- Pierwiastki chemiczne: Jak już wspomniałem, to zbiory atomów tego samego rodzaju, których nie da się rozłożyć na prostsze substancje metodami chemicznymi. Są to podstawowe cegiełki, z których zbudowany jest cały wszechświat. Przykłady to żelazo (Fe), tlen (O) czy węgiel (C). Każdy z tych pierwiastków ma unikalne właściwości.
- Związki chemiczne: To substancje złożone z atomów co najmniej dwóch różnych pierwiastków, które są połączone ze sobą wiązaniami chemicznymi w stałych proporcjach. Na przykład woda (H₂O) zawsze składa się z dwóch atomów wodoru i jednego atomu tlenu. Inny przykład to sól kuchenna (chlorek sodu, NaCl), która zawsze ma jeden atom sodu na jeden atom chloru. Związki chemiczne mają zupełnie inne właściwości niż pierwiastki, z których powstały.
Mieszaniny pod lupą: kiedy składniki widać, a kiedy nie?
Mieszaniny również dzielimy, ale kryterium jest tutaj sposób, w jaki składniki są ze sobą wymieszane i czy można je odróżnić gołym okiem. W ten sposób wyróżniamy mieszaniny jednorodne i niejednorodne.
Mieszaniny jednorodne idealnie wymieszane
Mieszaniny jednorodne, często nazywane roztworami, to układy, których składników nie można odróżnić gołym okiem ani za pomocą prostych narzędzi optycznych. Wyglądają jak jedna, spójna substancja. Przykładem jest powietrze, które jest mieszaniną wielu gazów (azotu, tlenu, argonu itd.), ale nie widzimy poszczególnych składników. Podobnie woda z cukrem po rozpuszczeniu cukier znika, a roztwór jest klarowny i jednolity.
Mieszaniny niejednorodne gdzie widać poszczególne składniki
Mieszaniny niejednorodne to takie układy, których składniki można łatwo odróżnić gołym okiem lub za pomocą lupy. Ich wygląd nie jest jednolity. Doskonałym przykładem jest woda z piaskiem wyraźnie widzimy oddzielne ziarenka piasku na dnie naczynia. Inny przykład to opiłki żelaza z siarką czarne opiłki żelaza i żółte grudki siarki są łatwo rozpoznawalne.
Jak opisać materię: poznaj jej najważniejsze właściwości
Aby w pełni zrozumieć materię, musimy nie tylko wiedzieć, z czego jest zbudowana i w jakich formach występuje, ale także jak się zachowuje. Do tego służy nam opis jej właściwości, które dzielimy na fizyczne i chemiczne. To właśnie dzięki nim możemy identyfikować substancje i przewidywać ich zachowanie.
Właściwości fizyczne: to, co widzisz i mierzysz bez zmiany składu
Właściwości fizyczne to cechy materii, które możemy zaobserwować lub zmierzyć, nie zmieniając przy tym jej składu chemicznego. Oznacza to, że substancja pozostaje tą samą substancją, nawet jeśli zmieniamy jej stan fizyczny. Kiedy na przykład topimy lód, woda zmienia stan skupienia, ale nadal jest wodą (H₂O).
Przykłady kluczowych właściwości fizycznych (gęstość, barwa, twardość)
Wśród najważniejszych właściwości fizycznych, które pomagają nam opisać materię, wymienić mogę:
- Stan skupienia: Czy substancja jest ciałem stałym, cieczą czy gazem w określonych warunkach.
- Barwa: Kolor substancji, np. miedź jest czerwonawo-brązowa, siarka żółta.
- Gęstość: Stosunek masy substancji do zajmowanej przez nią objętości. Na przykład ołów jest znacznie gęstszy niż aluminium.
- Twardość: Odporność na zarysowanie lub odkształcenie. Diament jest najtwardszym minerałem.
- Temperatura topnienia i wrzenia: Temperatury, w których substancja zmienia stan skupienia. Woda topi się w 0°C i wrze w 100°C (pod normalnym ciśnieniem).
- Przewodnictwo elektryczne: Zdolność do przewodzenia prądu elektrycznego. Metale są dobrymi przewodnikami.
Właściwości chemiczne: jak materia zachowuje się w reakcjach?
Właściwości chemiczne opisują zdolność substancji do wchodzenia w reakcje chemiczne, czyli do przekształcania się w inne substancje. Kiedy obserwujemy właściwości chemiczne, zawsze dochodzi do zmiany składu materii powstają nowe związki chemiczne.
Przykłady właściwości chemicznych (palność, rdzewienie, reaktywność)
Oto kilka przykładów właściwości chemicznych:
- Palność: Zdolność substancji do spalania się w obecności tlenu, np. drewno jest palne, woda nie.
- Reaktywność: Zdolność substancji do reagowania z innymi substancjami, np. żelazo reaguje z tlenem i wodą, tworząc rdzę. Kwasy reagują z metalami.
- Toksyczność: Zdolność substancji do wywoływania szkodliwych efektów w organizmach żywych.
- Smak i zapach: Choć często kojarzone z fizyką, są to właściwości chemiczne, ponieważ zmysły smaku i węchu wykrywają obecność konkretnych cząsteczek chemicznych.
"Nic nie ginie": dlaczego prawo zachowania masy jest fundamentem chemii?
Jedną z najważniejszych zasad rządzących światem chemii jest Prawo zachowania masy. To fundament, na którym opiera się cała stechiometria i zrozumienie reakcji chemicznych. Jako Daniel Kowalski, zawsze podkreślam jego znaczenie, ponieważ bez niego trudno byłoby nam przewidywać wyniki reakcji czy bilansować równania.
Na czym polega zasada zachowania masy w reakcjach chemicznych?
Prawo zachowania masy mówi, że w układzie zamkniętym łączna masa substratów użytych w reakcji chemicznej jest równa łącznej masie produktów tej reakcji. Innymi słowy, materia nie może być ani stworzona, ani zniszczona podczas reakcji chemicznej. Atomy po prostu przegrupowują się, tworząc nowe cząsteczki, ale ich całkowita liczba i masa pozostają niezmienione. To tak, jakbyś rozebrał domek z klocków i zbudował z nich samochód liczba klocków pozostaje taka sama, zmienia się tylko ich ułożenie.
Przeczytaj również: Jak zdać maturę z chemii? Sprawdzone strategie i materiały
Praktyczne znaczenie: dlaczego równania chemiczne muszą się zgadzać?
Praktyczne znaczenie Prawa zachowania masy jest ogromne. To właśnie dzięki niemu wiemy, że równania chemiczne muszą być zbilansowane. Kiedy piszemy równanie, na przykład dla spalania metanu (CH₄ + 2O₂ → CO₂ + 2H₂O), musimy upewnić się, że liczba atomów każdego pierwiastka po stronie substratów jest taka sama jak po stronie produktów. To nie jest tylko formalność to odzwierciedlenie rzeczywistości, w której atomy nie znikają ani nie pojawiają się znikąd. Zrozumienie tego prawa pozwala nam przewidywać, ile produktów powstanie z danej ilości substratów, co jest kluczowe zarówno w laboratorium, jak i w przemyśle chemicznym.