W świecie chemii, aby zrozumieć, jak substancje wchodzą ze sobą w interakcje, jak zachodzą reakcje i jakie prawa nimi rządzą, musimy najpierw jasno zdefiniować obszar naszych obserwacji. Tym właśnie jest układ chemiczny fundamentalne pojęcie, bez którego dalsza nauka staje się chaotyczna. W tym artykule, jako Daniel Kowalski, pomogę Ci krok po kroku zrozumieć, czym jest układ, jakie są jego rodzaje i dlaczego to właśnie od niego zaczyna się prawdziwe zgłębianie chemii.
Układ chemiczny fundamentalne pojęcie do zrozumienia zjawisk w świecie materii.
- Układ chemiczny to precyzyjnie zdefiniowana część wszechświata, będąca przedmiotem obserwacji lub badania, oddzielona od otoczenia granicą.
- Układy dzieli się ze względu na wymianę z otoczeniem na otwarte (wymiana materii i energii), zamknięte (wymiana tylko energii) i izolowane (brak wymiany).
- Ze względu na liczbę faz wyróżniamy układy homogeniczne (jednofazowe, o jednolitych właściwościach) i heterogeniczne (wielofazowe, z wyraźnymi granicami między fazami).
- Faza to jednolita pod względem fizycznym i chemicznym część układu, a składnik to substancja chemiczna tworząca układ.
- Zrozumienie pojęcia układu jest kluczowe dla dalszej nauki chemii, w tym termodynamiki i kinetyki.
Czym jest układ chemiczny i dlaczego to pojęcie jest kluczowe?
W chemii, gdy mówimy o układzie, mamy na myśli precyzyjnie zdefiniowaną część wszechświata, która jest przedmiotem naszej obserwacji lub badania. Może to być coś tak prostego jak zlewka z roztworem, probówka, w której zachodzi reakcja, a nawet cały silnik spalinowy czy pojedyncza komórka. Wszystko, co znajduje się poza tym obszarem, nazywamy otoczeniem układu. Między układem a otoczeniem zawsze istnieje jakaś granica czasem jest ona fizyczna, jak ścianki naczynia, a czasem tylko umowna, czyli taka, którą wyznaczamy sobie w myślach, aby ułatwić analizę danego zjawiska.
Dlaczego bez zrozumienia "układu" dalsza nauka chemii nie ma sensu?
Z mojego doświadczenia wynika, że pojęcie układu jest absolutnie fundamentalne. Bez jego zrozumienia trudno jest przejść do bardziej zaawansowanych zagadnień, takich jak termodynamika chemiczna, która bada przepływy energii, czy kinetyka chemiczna, zajmująca się szybkością reakcji. Nawet zrozumienie równowag chemicznych wymaga jasnego określenia, co jest układem, a co otoczeniem. W polskim systemie edukacji zagadnienie układu wprowadzane jest już na wczesnych etapach nauczania chemii, co świadczy o jego kluczowym znaczeniu. To podstawa, na której buduje się całą dalszą wiedzę chemiczną.
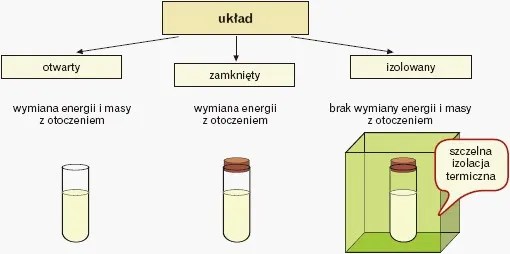
Podstawowy podział układów: Jak wymieniają materię i energię z otoczeniem?
Jednym z najważniejszych kryteriów podziału układów chemicznych jest sposób, w jaki wymieniają one materię i energię ze swoim otoczeniem. To właśnie ta wymiana decyduje o wielu właściwościach i zachowaniach układu.
Układ otwarty: Kiedy materia i energia swobodnie przepływają
Układ otwarty to taki, który ma swobodną możliwość wymiany zarówno materii, jak i energii z otoczeniem. Oznacza to, że substancje mogą do niego wchodzić i z niego wychodzić, a energia (np. w postaci ciepła czy pracy) również może swobodnie przepływać przez jego granice. Jest to najczęściej spotykany typ układu w codziennym życiu.
Czym jest kubek gorącej herbaty z perspektywy chemika?
Wyobraź sobie kubek z gorącą herbatą stojący na stole. To doskonały przykład układu otwartego. Po pierwsze, herbata paruje to jest wymiana materii z otoczeniem (para wodna ucieka do powietrza). Po drugie, herbata stygnie to jest wymiana energii (ciepło ucieka z kubka do otoczenia). Widzisz więc, jak w tym prostym przykładzie zachodzi zarówno przepływ materii, jak i energii.
Inne przykłady układów otwartych w Twoim otoczeniu
- Płonące ognisko: Spala się drewno (materia), uwalniając dym i gazy (wymiana materii) oraz ciepło i światło (wymiana energii).
- Człowiek: Oddychamy (wymiana tlenu i dwutlenku węgla), pocimy się (wymiana wody), jemy (wymiana materii), a nasze ciało oddaje ciepło (wymiana energii).
- Gotująca się woda w otwartym garnku: Woda paruje (materia), a ciepło ucieka do otoczenia (energia).
Układ zamknięty: Energia na zewnątrz, materia pozostaje w środku
W przeciwieństwie do układu otwartego, układ zamknięty to taki, który może wymieniać z otoczeniem jedynie energię, ale nie wymienia materii. Oznacza to, że masa substancji wewnątrz układu pozostaje stała, nawet jeśli jego temperatura czy ciśnienie się zmieniają.
Szczelnie zamknięta butelka: Idealny model układu zamkniętego
Pomyśl o szczelnie zakręconej butelce z wodą mineralną. Jeśli postawisz ją na słońcu, woda w środku się ogrzeje (wymiana energii w postaci ciepła). Jeśli włożysz ją do lodówki, ochłodzi się (również wymiana energii). Jednakże, dopóki butelka jest szczelnie zamknięta, ilość wody w środku pozostaje niezmieniona. Nie ubywa jej ani nie przybywa. To klasyczny przykład układu zamkniętego.
Układ izolowany: Czy istnieje idealna forteca bez wymiany?
Układ izolowany to najbardziej teoretyczny z trzech typów. Jest to układ, który nie wymienia ani materii, ani energii z otoczeniem. W praktyce jest to niemal niemożliwe do osiągnięcia, ponieważ zawsze występują jakieś, choćby minimalne, przepływy. Traktujemy go raczej jako model idealny, do którego dążymy w eksperymentach.
Termos jako najlepsze przybliżenie układu izolowanego w praktyce
Najlepszym praktycznym przybliżeniem układu izolowanego jest wysokiej jakości termos, znany również jako naczynie Dewara. Jego specjalna konstrukcja, często z podwójnymi ściankami i próżnią między nimi, ma za zadanie maksymalnie zminimalizować wymianę ciepła (energii) z otoczeniem. Chociaż nawet termos po pewnym czasie odda ciepło, przez długi okres bardzo skutecznie opóźnia ten proces, co czyni go użytecznym modelem układu izolowanego w laboratorium.
Układ jednorodny czy niejednorodny? Jak rozpoznać go po wyglądzie i fazach?
Kolejny ważny podział układów dotyczy ich wewnętrznej struktury, a konkretnie tego, czy ich właściwości są jednakowe w każdej części, czy też wyraźnie się różnią.
Układ homogeniczny: Gdzie wszystko wygląda tak samo
Układ homogeniczny, nazywany również jednorodnym lub jednofazowym, to taki, którego właściwości fizyczne i chemiczne są jednakowe w każdej jego części lub zmieniają się w sposób ciągły (np. w gradiencie). Oznacza to, że patrząc na niego, nie jesteśmy w stanie rozróżnić żadnych oddzielnych składników ani obszarów o różnych cechach. Składa się on z tylko jednej fazy.
Czym jest faza i dlaczego w układzie jednorodnym jest tylko jedna?
Pojęcie fazy jest tu kluczowe. Faza to jednolita pod względem fizycznym i chemicznym część układu, która jest oddzielona od innych części wyraźną granicą. W układzie jednorodnym, ponieważ wszystko wygląda i zachowuje się tak samo, nie ma żadnych wyraźnych granic, które oddzielałyby od siebie różne obszary. Dlatego też, z definicji, układ jednorodny zawsze składa się tylko z jednej fazy.
Przykłady, które znasz: Powietrze, woda z cukrem, stopy metali
- Czysta woda: Niezależnie od tego, skąd pobierzesz próbkę, ma te same właściwości.
- Roztwór soli w wodzie: Po rozpuszczeniu soli, nie widać już jej kryształków, a cały roztwór jest klarowny i ma jednolite właściwości.
- Powietrze: To mieszanina gazów (azotu, tlenu, argonu itp.), ale jest tak dobrze wymieszana, że nie widzimy poszczególnych gazów.
- Stop metali (np. mosiądz): Mimo że składa się z miedzi i cynku, wygląda jak jednolity metal.
Układ heterogeniczny: Świat wielu faz i wyraźnych granic
Z kolei układ heterogeniczny, czyli niejednorodny lub wielofazowy, to układ, który składa się z co najmniej dwóch faz. Te fazy są od siebie wyraźnie oddzielone granicami międzyfazowymi, a ich właściwości fizyczne i chemiczne są różne w różnych częściach układu. Możemy go łatwo rozpoznać, ponieważ zazwyczaj widzimy w nim różne "warstwy" lub "elementy".
Co sprawia, że woda z olejem to podręcznikowy przykład układu niejednorodnego?
Klasycznym przykładem układu niejednorodnego jest woda z olejem. Olej i woda nie mieszają się ze sobą, tworząc dwie wyraźnie oddzielone warstwy. Mamy tu więc dwie fazy: fazę wodną i fazę olejową. Między nimi istnieje wyraźna granica międzyfazowa, którą możemy zobaczyć gołym okiem. Właściwości fizyczne (gęstość, lepkość) i chemiczne (rozpuszczalność) tych dwóch faz są zupełnie różne.
Piasek w wodzie, granit i mgła: Różne oblicza układów wielofazowych
- Woda z piaskiem: Widzimy oddzielne ziarnka piasku na dnie i wodę nad nimi dwie fazy: stała i ciekła.
- Granit: To skała składająca się z różnych minerałów (np. kwarc, skaleń, mika), które są widoczne jako oddzielne kryształki o różnych kolorach i kształtach wiele faz stałych.
- Dym lub mgła: Dym to cząstki stałe w gazie, a mgła to kropelki cieczy w gazie. W obu przypadkach mamy do czynienia z dwoma fazami (stałą/ciekłą i gazową), które są rozproszone, ale nadal odrębne.
Składniki i fazy: Jak poprawnie określić budowę układu?
Rozróżnianie faz i składników jest kluczowe dla pełnego zrozumienia budowy układu chemicznego. To nie zawsze jest tak oczywiste, jak mogłoby się wydawać na pierwszy rzut oka.
Jeden składnik, wiele faz: Jak woda z lodem tworzy układ wielofazowy?
Zacznijmy od definicji: składnik to substancja chemiczna tworząca układ. Układ może być jednoskładnikowy (np. czysta woda) lub wieloskładnikowy (np. roztwór cukru w wodzie). Co ciekawe, układ może składać się z jednego składnika, ale wielu faz. Najlepszym przykładem jest woda z lodem. Zarówno lód, jak i woda to chemicznie ta sama substancja (H₂O). Mamy więc tylko jeden składnik. Jednakże, lód jest fazą stałą, a woda jest fazą ciekłą. Są one wyraźnie oddzielone i mają różne właściwości fizyczne (np. gęstość). Mamy więc do czynienia z układem dwufazowym, jednoskładnikowym.
Wiele składników, jedna faza: Tajemnica prawdziwych roztworów
Z drugiej strony, możemy mieć wiele składników, ale tylko jedną fazę. Dzieje się tak w przypadku prawdziwych roztworów. Weźmy na przykład roztwór cukru w wodzie. Mamy tu dwa składniki: cukier i wodę. Po dokładnym wymieszaniu cukier całkowicie rozpuszcza się w wodzie, tworząc jednorodną mieszaninę. Nie widzimy już oddzielnych kryształków cukru, a cały roztwór ma jednolite właściwości. Jest to więc układ jednofazowy, dwuskładnikowy.
Przeczytaj również: Nauka chemii od zera: Czy to możliwe? Twój plan sukcesu!
Jak poprawnie określić liczbę składników i faz w danym układzie?
- Liczba składników: Określ, ile różnych substancji chemicznych (np. H₂O, NaCl, C₁₂H₂₂O₁₁) tworzy układ. Pamiętaj, że różne stany skupienia tej samej substancji to wciąż ten sam składnik.
- Liczba faz: Zidentyfikuj, ile jednolitych pod względem fizycznym i chemicznym obszarów jest w układzie, które są oddzielone wyraźnymi granicami. Nawet jeśli te obszary składają się z tej samej substancji, ale w innym stanie skupienia (np. lód i woda), liczą się jako osobne fazy.
- Obserwacja: Często wystarczy dokładna obserwacja, aby rozróżnić fazy czy widzisz wyraźne warstwy, osady, czy może wszystko wygląda jednolicie?

