Zrozumienie mola to jeden z tych momentów w nauce chemii, które potrafią zmienić wszystko. To nie tylko kolejna jednostka miary, ale prawdziwy klucz do świata atomów i cząsteczek, który pozwala nam, chemikom, pracować z nimi w sposób praktyczny i mierzalny. Bez mola, cała stechiometria czyli serce obliczeń chemicznych byłaby niemożliwa do opanowania.
Mol kluczowa jednostka, która łączy świat atomów z codziennymi pomiarami w chemii
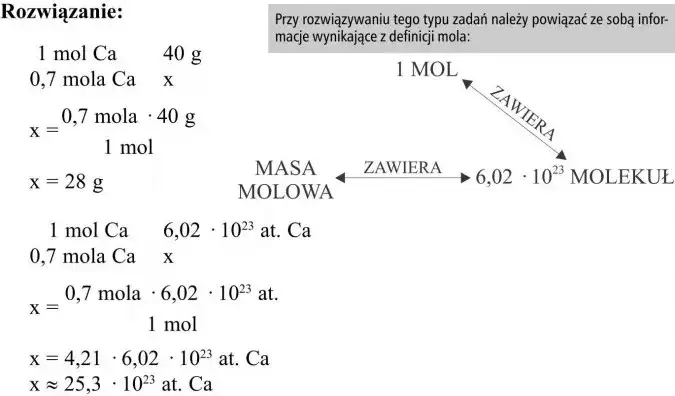
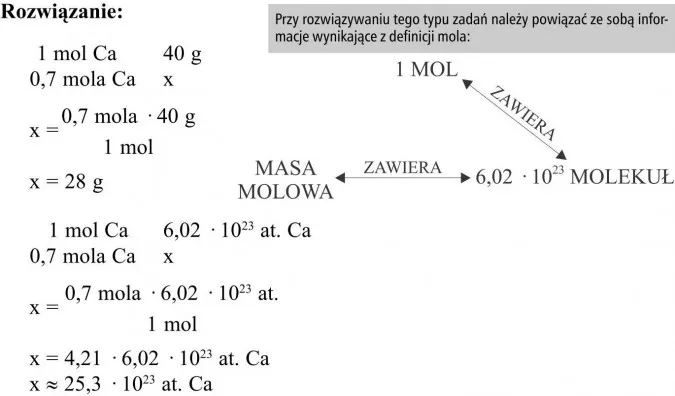
- Mol to podstawowa jednostka liczności materii w układzie SI, reprezentująca stałą liczbę obiektów elementarnych.
- Jeden mol zawiera dokładnie 6,02214076 × 10²³ drobin, czyli stałą Avogadra (NA).
- Mol pozwala przeliczać masę substancji (gramy) na liczbę atomów lub cząsteczek, stanowiąc most między skalą makro i mikro.
- Masa molowa (M) to masa jednego mola substancji, wyrażana w g/mol, a jej wartość dla pierwiastka jest równa masie atomowej.
- Zrozumienie mola jest niezbędne do obliczeń stechiometrycznych i precyzyjnego prowadzenia reakcji chemicznych.
Dlaczego mol to najważniejsze słowo, jakie poznasz na lekcji chemii?
Kiedy po raz pierwszy spotykamy się z pojęciem mola, może wydawać się ono abstrakcyjne i skomplikowane. Jednak z mojego doświadczenia wiem, że to właśnie mol jest tym fundamentem, na którym buduje się całą dalszą wiedzę chemiczną. Wyobraź sobie, że masz do czynienia z atomami są one niewyobrażalnie małe, a ich indywidualne liczenie jest po prostu niemożliwe. Mol jest genialnym rozwiązaniem tego problemu. Działa jak most, który łączy świat, w którym operujemy na gramach i kilogramach (czyli tym, co możemy zważyć w laboratorium), ze światem niewidzialnych atomów i cząsteczek. Dzięki niemu możemy przewidywać, ile produktu powstanie z danej ilości substratu, co jest absolutnie kluczowe w każdej reakcji chemicznej.
Chemia to liczenie w skali makro: jak mol łączy gramy z atomami
Aby lepiej zrozumieć mola, często posługuję się prostą analogią. Pomyśl o "tuzinie" jajek to po prostu nazwa dla konkretnej liczby (dwunastu) jajek. Podobnie "kopa" oznacza sześćdziesiąt sztuk. Mol działa na tej samej zasadzie, tylko że zamiast 12 czy 60, mamy do czynienia z niewyobrażalnie większą liczbą. To po prostu nazwa dla bardzo dużej, ale ściśle określonej liczby obiektów elementarnych. Dzięki temu chemicy nie muszą mówić o "bilionach bilionów" atomów, ale mogą operować wygodniejszą jednostką molem. To znacznie ułatwia pracę i sprawia, że obliczenia stają się bardziej przystępne.
Co to jest mol? Rozszyfrowujemy definicję krok po kroku
Przejdźmy do sedna. Mol to podstawowa jednostka liczności materii w układzie SI. Co to dokładnie oznacza? Otóż jeden mol substancji zawiera dokładnie 6,02214076 × 10²³ obiektów elementarnych. Te obiekty to mogą być atomy, cząsteczki, jony, elektrony, czy cokolwiek innego, co chcemy policzyć. Ta konkretna wartość to nic innego jak stała Avogadra, oznaczana jako NA. Ważne jest, aby zapamiętać, że mol zawsze odnosi się do tej samej liczby drobin, niezależnie od tego, czy mówimy o molu wody, molu złota czy molu tlenu.
Poznaj magiczną liczbę chemii: kim był Avogadro i co nam dał?
Za tą "magiczną" liczbą stoi włoski naukowiec Amedeo Avogadro, który na początku XIX wieku sformułował hipotezę dotyczącą objętości gazów. Chociaż sama stała Avogadra nie została przez niego bezpośrednio wyznaczona, jego prace były kluczowe dla jej późniejszego odkrycia i zrozumienia. Co ciekawe, wartość stałej Avogadra, którą podałem powyżej (6,02214076 × 10²³), została zdefiniowana na nowo w 2019 roku. Obecnie jest to stała wartość, a nie liczba wyznaczana eksperymentalnie. Wcześniej była ona definiowana jako liczba atomów w dokładnie 12 gramach izotopu węgla ¹²C. Ta redefinicja podkreśla jej fundamentalne znaczenie w nauce.
Wizualizacja liczby Avogadra: jak ogromna jest to wartość?
Liczba 6,02214076 × 10²³ jest tak ogromna, że trudno ją sobie wyobrazić. Aby dać Ci perspektywę, pomyślmy o ziarnkach piasku. Gdybyś chciał odliczyć liczbę Avogadra ziarenek piasku, i liczyłbyś jedno ziarenko na sekundę, zajęłoby Ci to ponad 19 biliardów lat! To dłużej niż wiek Wszechświata. Inna analogia: gdybyśmy rozłożyli jeden mol ziarenek grochu na całej powierzchni Ziemi, pokryłyby ją one warstwą o grubości kilkudziesięciu metrów. To pokazuje, jak potężną jednostką jest mol i jak wiele drobin zawiera.
Masa molowa, czyli jak zważyć jednego mola?
Skoro wiemy już, ile drobin zawiera jeden mol, naturalnie pojawia się pytanie: ile waży jeden mol danej substancji? Tutaj wkracza pojęcie masy molowej (M). Masa molowa to masa jednego mola substancji, wyrażona w gramach na mol (g/mol). Ważne jest, aby odróżnić ją od masy atomowej (wyrażanej w unitach "u") czy masy cząsteczkowej. Kluczowa zależność jest taka, że wartość liczbowa masy molowej pierwiastka jest równa jego masie atomowej. Na przykład, jeśli masa atomowa węgla wynosi około 12 u, to masa molowa węgla wynosi 12 g/mol. To niezwykle wygodne uproszczenie, które pozwala nam łatwo przechodzić od skali atomowej do makroskopowej.
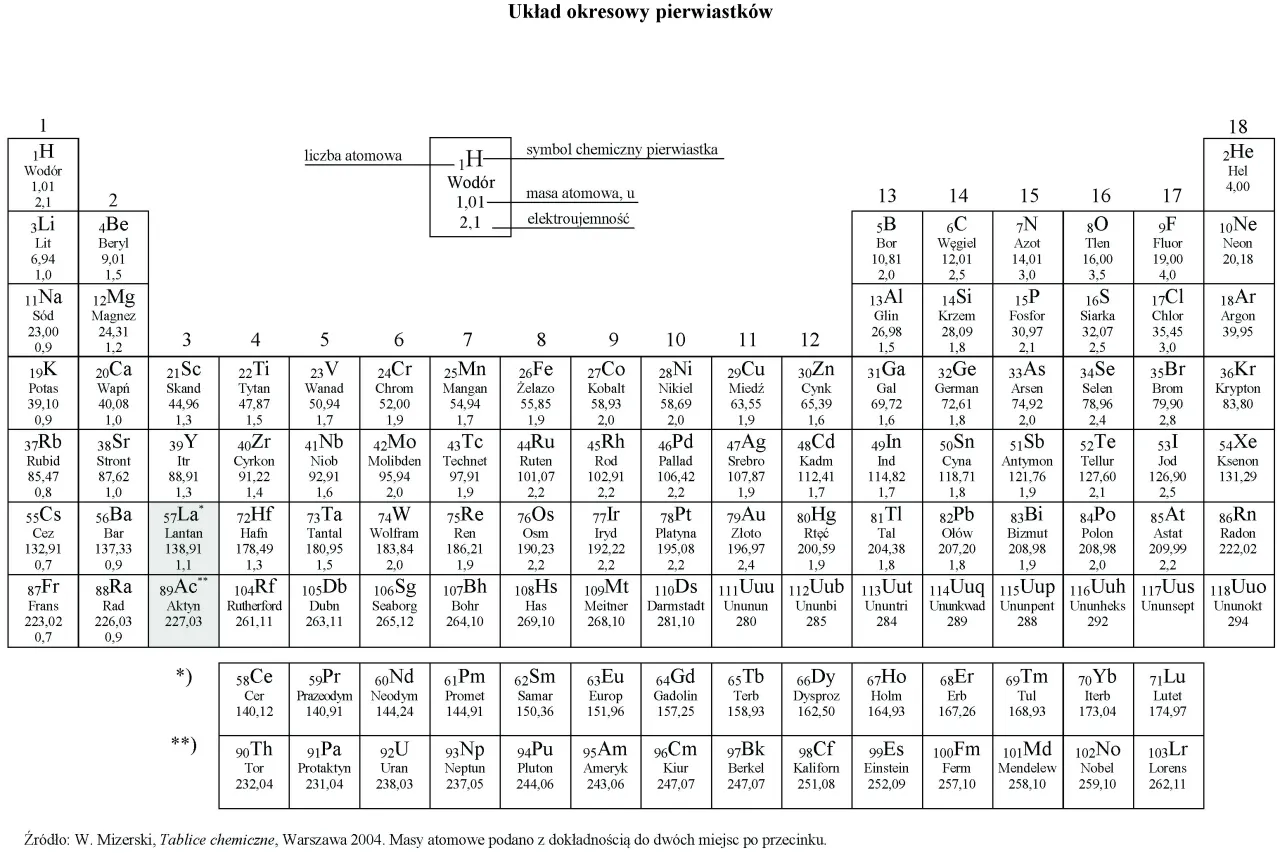
Jak odczytać masę molową pierwiastka prosto z układu okresowego?
Odczytanie masy molowej pierwiastka z układu okresowego to jedna z najprostszych rzeczy w chemii. Oto jak to zrobić krok po kroku:
- Znajdź pierwiastek: Odszukaj interesujący Cię pierwiastek w układzie okresowym.
- Zlokalizuj masę atomową: W większości układów okresowych masa atomowa jest podana pod symbolem pierwiastka, zazwyczaj jako liczba dziesiętna.
- Zmień jednostkę: Wartość liczbowa, którą odczytasz (np. dla tlenu będzie to około 16), to jego masa atomowa w unitach (u). Aby uzyskać masę molową, po prostu zmień jednostkę na gramy na mol (g/mol). Zatem masa molowa tlenu wynosi 16 g/mol.
Obliczanie masy molowej związków chemicznych: praktyczny poradnik (np. H₂O, CO₂)
Obliczanie masy molowej dla związków chemicznych jest równie proste i polega na sumowaniu mas molowych wszystkich atomów wchodzących w skład cząsteczki, z uwzględnieniem ich liczby. Pokażę to na przykładach:
Przykład 1: Obliczanie masy molowej wody (H₂O)
Woda składa się z dwóch atomów wodoru (H) i jednego atomu tlenu (O).
- Masa molowa wodoru (H) ≈ 1 g/mol
- Masa molowa tlenu (O) ≈ 16 g/mol
Obliczenie:
M(H₂O) = (2 × M(H)) + (1 × M(O))
M(H₂O) = (2 × 1 g/mol) + (1 × 16 g/mol)
M(H₂O) = 2 g/mol + 16 g/mol
M(H₂O) = 18 g/mol
Przykład 2: Obliczanie masy molowej dwutlenku węgla (CO₂)
Dwutlenek węgla składa się z jednego atomu węgla (C) i dwóch atomów tlenu (O).
- Masa molowa węgla (C) ≈ 12 g/mol
- Masa molowa tlenu (O) ≈ 16 g/mol
Obliczenie:
M(CO₂) = (1 × M(C)) + (2 × M(O))
M(CO₂) = (1 × 12 g/mol) + (2 × 16 g/mol)
M(CO₂) = 12 g/mol + 32 g/mol
M(CO₂) = 44 g/mol
Klucz do sukcesu: jak obliczać mole bezbłędnie?
Teraz, gdy rozumiemy już, czym jest mol i masa molowa, możemy przejść do podstawowych wzorów, które pozwalają nam wykonywać obliczenia. Pierwszy i najważniejszy wzór pozwala przeliczyć masę substancji na liczbę moli. Jest to absolutna podstawa w chemii i musisz go znać na pamięć. Wzór ten łączy masę próbki z jej masą molową, dając nam liczbę moli.
n = m / M
- n liczba moli (jednostka: mol)
- m masa próbki substancji (jednostka: gramy, g)
- M masa molowa substancji (jednostka: gramy na mol, g/mol)
Przykład: Ile moli znajduje się w 9 gramach wody (H₂O)?
Wiemy, że M(H₂O) = 18 g/mol (jak obliczyliśmy wcześniej).
n = 9 g / 18 g/mol = 0,5 mol
Przeliczanie liczby cząsteczek na mole (n = N/NA)
Drugi kluczowy wzór pozwala nam przeliczać liczbę pojedynczych drobin (atomów, cząsteczek) na mole. Jest to szczególnie przydatne, gdy chcemy wiedzieć, ile moli odpowiada konkretnej liczbie cząsteczek, co często ma miejsce w bardziej zaawansowanych problemach chemicznych.
n = N / NA
- n liczba moli (jednostka: mol)
- N liczba drobin (atomów, cząsteczek, jonów)
- NA stała Avogadra (6,02214076 × 10²³ mol⁻¹)
Przykład: Ile moli atomów węgla znajduje się w próbce zawierającej 3,011 × 10²³ atomów węgla?
n = (3,011 × 10²³ atomów) / (6,022 × 10²³ atomów/mol) = 0,5 mol
Specjalny przypadek: Jak wykorzystać objętość molową gazów w warunkach normalnych?
Dla gazów istnieje jeszcze jedno bardzo przydatne pojęcie objętość molowa. W warunkach normalnych (czyli w temperaturze 0°C i pod ciśnieniem 1013,25 hPa) jeden mol dowolnego gazu doskonałego zajmuje objętość 22,4 dm³. To jest niezwykle ważne uproszczenie w obliczeniach, ponieważ oznacza, że niezależnie od tego, czy mówimy o molu tlenu, azotu czy wodoru, w tych konkretnych warunkach zawsze zajmą tę samą objętość. Warto również pamiętać o warunkach standardowych (25°C, 1000 hPa), gdzie objętość molowa wynosi 24,79 dm³. Pamiętaj jednak, że te wartości stosujemy tylko i wyłącznie dla gazów i tylko w określonych warunkach temperatury i ciśnienia.
Po co nam to wszystko? Zastosowanie mola w praktyce
Zrozumienie mola to nie tylko teoria to podstawa praktycznej chemii. Mol jest fundamentem stechiometrii, czyli tej gałęzi chemii, która zajmuje się ilościowymi zależnościami między substratami a produktami w reakcjach chemicznych. Dzięki molowi możemy "przeliczać" masy substratów na ich ilości, a następnie przewidywać, ile produktu powstanie. To pozwala nam na precyzyjne planowanie eksperymentów i optymalizację procesów chemicznych. Bez mola, chemia byłaby jedynie sztuką zgadywania, a nie nauką opartą na dokładnych obliczeniach.
Od teorii do laboratorium: rola mola w przygotowywaniu roztworów
W laboratorium mol jest moim nieodłącznym towarzyszem, zwłaszcza podczas przygotowywania roztworów o określonym stężeniu. Jeśli chcę przygotować roztwór o konkretnym stężeniu molowym (np. 1 mol/dm³), muszę dokładnie wiedzieć, ile gramów substancji rozpuścić w danej objętości rozpuszczalnika. To właśnie mol pozwala mi na wykonanie tych precyzyjnych obliczeń. Odmierzenie odpowiedniej masy substancji, przeliczenie jej na mole, a następnie rozpuszczenie w odpowiedniej objętości to codzienna praktyka, która wymaga doskonałego opanowania koncepcji mola.
Najczęstsze pułapki i błędy: na co uważać przy zadaniach z mola?
Podczas mojej pracy ze studentami zauważyłem kilka powtarzających się błędów, które często utrudniają zrozumienie mola. Jednym z najczęstszych jest mylenie masy molowej z masą cząsteczkową. Pamiętaj, masa cząsteczkowa (lub atomowa) jest wyrażana w unitach (u) i odnosi się do masy jednej cząsteczki (lub atomu), natomiast masa molowa (M) jest wyrażana w g/mol i odnosi się do masy całego mola, czyli 6,022 × 10²³ cząsteczek (lub atomów). Choć wartości liczbowe są takie same, jednostki i ich znaczenie są fundamentalnie różne.
Przeczytaj również: Chemia mydła: Jak powstaje i działa? Definicja i rodzaje
Diabeł tkwi w jednostkach: dlaczego gramy i decymetry sześcienne mają znaczenie?
Kolejnym źródłem pomyłek są jednostki. W chemii precyzja jest kluczowa, a błędy w jednostkach mogą prowadzić do katastrofalnych wyników. Oto na co szczególnie zwracać uwagę:
- Masa: Zawsze upewnij się, że masa próbki jest wyrażona w gramach (g), jeśli masa molowa jest w g/mol. Jeśli masz kilogramy, przelicz je na gramy.
- Objętość: Przy objętości molowej gazów (22,4 dm³ lub 24,79 dm³) pamiętaj, że objętość musi być w decymetrach sześciennych (dm³). Często uczniowie zapominają przeliczyć centymetry sześcienne (cm³) na dm³ (1 dm³ = 1000 cm³).
- Warunki: Stosowanie objętości molowej gazów (22,4 dm³ lub 24,79 dm³) jest ściśle związane z warunkami normalnymi lub standardowymi. Jeśli temperatura i ciśnienie są inne, nie możesz używać tych wartości bezpośrednio i musisz skorzystać z równania Clapeyrona.
- Stała Avogadra: Pamiętaj, że stała Avogadra ma jednostkę mol⁻¹, co oznacza "na mol". To pomaga w prawidłowym skracaniu jednostek w obliczeniach.